Diferencia entre el punto de equivalencia y el punto final
El diferencia clave entre el punto de equivalencia y el punto final es que el El punto de equivalencia en una titulación es el punto en el que el titizante agregado es químicamente equivalente completamente al analito en la muestra, mientras que el punto final es el punto donde el indicador cambia de color.
La titulación es una técnica que utilizamos ampliamente en química analítica para determinar ácidos, bases, oxidantes, reductores, iones metálicos y muchas otras especies. En una titulación, tiene lugar una reacción química. Aquí, un analito reacciona con un reactivo estándar, que llamamos como un titulante. A veces usamos un estándar primario, que es una solución altamente purificada y estable, como material de referencia en métodos titrimétricos. Usamos un indicador para detectar el punto final de la reacción. Pero, no es el punto real donde termina la reacción química. El punto real es el punto de equivalencia.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el punto final
3. ¿Qué es el punto de equivalencia?
4. Comparación de lado a lado: punto de equivalencia vs punto final en forma tabular
5. Resumen
Que es el punto final?
En cualquier titulación, el punto final es el punto donde el indicador cambia su color. O de lo contrario podemos usar un cambio en una respuesta instrumental para identificar el punto final. Por ejemplo, HCl y NaOH reaccionan 1: 1 y producen NaCl y agua. Para esta titulación, podemos usar el indicador de fenolftaleína, que tiene un color rosa en el medio básico y se convierte en incoloro en el medio ácido. Si ponemos HCL en el matraz de titulación y a eso, si agregamos una gota de fenolftaleína, se vuelve incoloro.

Figura 02: El punto final es el punto de cambio de color
Durante la titulación, podemos agregar NaOH de Burette y gradualmente, HCl y NaOH reaccionarán en el matraz. Si tomamos la misma concentración de las dos soluciones, cuando agregamos una cantidad igual de NaOH al matraz, la solución en el matraz se convertirá en un color rosa claro. Este es el punto donde detenemos la titulación (punto final). Consideramos, en este punto, la reacción se completa.
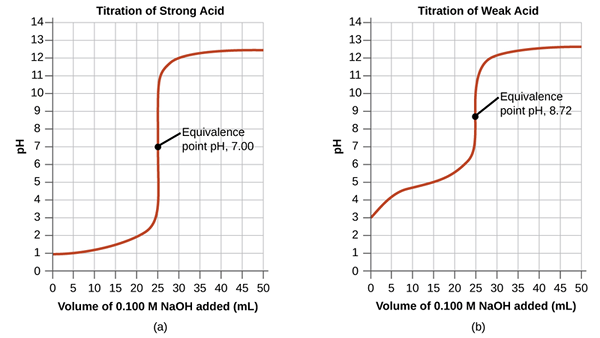
¿Qué es el punto de equivalencia??
El punto de equivalencia en una titulación es el punto en el que el titizante agregado es químicamente equivalente por completo al analito en la muestra. Este es el punto en el que la reacción química completa estequiométricamente.

Figura 01: puntos de equivalencia para ácido fuerte y titulación de ácido débil
Aunque determinamos el punto final del cambio de color del indicador, es, la mayoría de las veces, no el punto final real de la reacción. La reacción se completa ligeramente antes de ese punto. En este punto de equivalencia, el medio es neutral. En el ejemplo discutido en la sección anterior, después de agregar una caída adicional de NaOH, el medio mostrará el color básico de la fenolftaleína, que tomamos como punto final.
¿Cuál es la diferencia entre el punto de equivalencia y el punto final??
El punto de equivalencia en una titulación es el punto en el que el titizante agregado es químicamente equivalente completamente al analito en la muestra, mientras que el punto final es el punto donde el indicador cambia de color. Esta es la principal diferencia entre el punto de equivalencia y el punto final. Además, el punto de equivalencia siempre viene antes del punto final de la titulación.

Resumen - punto de equivalencia vs punto final
En cualquier titulación, tenemos dos puntos importantes; a saber, punto equivalente y punto final de la titulación. La diferencia clave entre el punto de equivalencia y el punto final es que el punto de equivalencia en una titulación es el punto en el que el titulante agregado es químicamente equivalente completamente al analito en la muestra, mientras que el punto final es el punto donde el indicador cambia su color.
Referencia:
1. "Punto de equivalencia."Wikipedia, Fundación Wikimedia, 15 de abril. 2018. Disponible aquí
2. Bibliotecas. "Fundamentos de titulación."Bibliotecas de química, Librettexts, 21 de julio de 2016. Disponible aquí
Imagen de cortesía:
1."CNX Chem 14 07 Titulación" por OpenStax (CC por 4.0) a través de Commons Wikimedia
2."Phenolphthalein in Flask" por 384 - Trabajo propio, (CC By -SA 4.0) a través de Commons Wikimedia


