Diferencia entre etilamina y anilina
El diferencia clave entre etilamina y anilina es que La etilamina es un compuesto alifático, mientras que la anilina es un compuesto aromático.
Tanto la etilamina como la anilina son compuestos orgánicos que tienen el grupo amina (-nh2). En etilamina, el grupo amina se une a un grupo etilo, pero en anilina, el grupo amina se une a un anillo de benceno.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la etilamina?
3. Que es anilina
4. Comparación de lado a lado: etilamina vs anilina en forma tabular
5. Resumen
¿Qué es la etilamina??
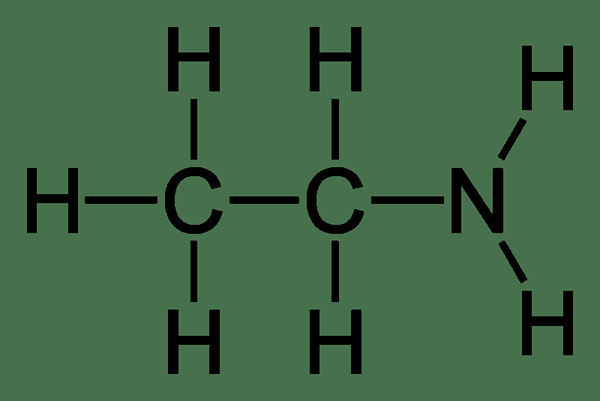
La etilamina es un compuesto orgánico alifático que tiene la fórmula química3Pez2NUEVA HAMPSHIRE2. Ocurre como un gas incoloro y tiene un olor fuerte similar al amoníaco. Por lo general, es miscible con todos los solventes. La masa molar de este compuesto es 45.08 g/mol.

Figura 01: Estructura de etilamina
En la síntesis de etilamina, hay dos procesos principales para la producción a gran escala de este compuesto. El método más común es la reacción entre el etanol y el amoníaco en presencia de un catalizador. El otro método común es la aminación reductora del acetaldehído.
Hay varias aplicaciones importantes de etilamina. Es un precursor de la producción de herbicidas como Atrazine y Simazine. Además, es un precursor útil para la síntesis de agentes anestésicos disociativos de ciclidina.
Que es anilina?
La anilina es un compuesto orgánico aromático que tiene la fórmula química C6H5NUEVA HAMPSHIRE2. Tiene un anillo de benceno (un grupo fenilo) unido a un grupo de amina (-nh2). Es la amina aromática más simple porque no hay componentes que no sean el grupo amina y el anillo aromático. Además, este compuesto está ligeramente piramidalizado y es más plano que una amina alifática. Su masa molar es 93.13 g/mol. Además, su punto de fusión es −6.3 ° C mientras que el punto de ebullición es 184.13 ° C. Tiene el olor de peces podridos.
Industrialmente, podemos producir este compuesto a través de dos pasos. El primer paso es la nitración de benceno con una mezcla concentrada de ácido nítrico y ácido sulfúrico (a 50 a 60 ° C). Da nitrobenceno. Luego podemos hidrogenar el nitrobenceno en anilina en presencia de un catalizador de metal. La reacción es la siguiente:
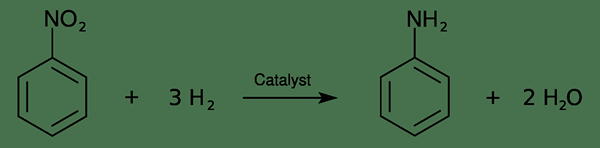
Además, con respecto al uso, este compuesto se utiliza principalmente en la fabricación de precursores de poliuretano. Además de eso, podemos usar este compuesto en la producción de tintes, drogas, materiales explosivos, plásticos, productos químicos fotográficos y gomosos, etc.
¿Cuál es la diferencia entre etilamina y anilina??
La etilamina es un compuesto orgánico alifático que tiene la fórmula química3Pez2NUEVA HAMPSHIRE2 mientras que la anilina es un compuesto orgánico aromático que tiene la fórmula química C6H5NUEVA HAMPSHIRE2. La diferencia clave entre la etilamina y la anilina es que la etilamina es un compuesto alifático, mientras que la anilina es un compuesto aromático. Además, la etilamina ocurre como un gas incoloro, pero la anilina ocurre como un líquido incoloro a amarillo.
Al considerar los procesos de producción, hay dos procesos para la etilamina: la reacción entre el etanol y el amoníaco en presencia de un catalizador y la aminación reductora de acetaldehído. Además, para la anilina, hay dos pasos para la producción: nitración de benceno con una mezcla concentrada de ácido nítrico y ácido sulfúrico seguido de nitrobenceno hidrogenante en anilina en presencia de un catalizador de metal.
A continuación, la infografía da más datos sobre la diferencia entre la etilamina y la anilina.
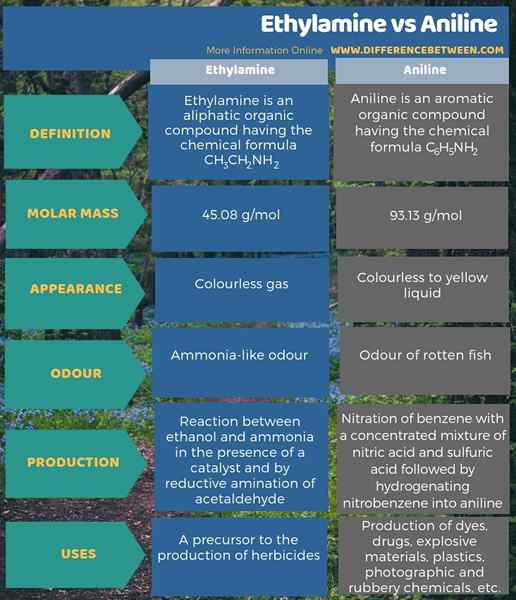
Resumen -etilamina vs anilina
La etilamina es un compuesto orgánico alifático que tiene la fórmula química3Pez2NUEVA HAMPSHIRE2 mientras que la anilina es un compuesto orgánico aromático que tiene la fórmula química C6H5NUEVA HAMPSHIRE2. En resumen, la diferencia clave entre la etilamina y la anilina es que la etilamina es un compuesto alifático, mientras que la anilina es un compuesto aromático.
Referencia:
1. "Anilina." Wikipedia, Fundación Wikimedia, 9 de junio de 2019, disponible aquí.
Imagen de cortesía:
1. "Etilamina-2D-Flat" de Hermann Luyken-Trabajo propio (CC0) a través de Commons Wikimedia
2. "Anilina del nitrobenceno" por Benjah -BMM27 - Trabajo propio (dominio público) a través de Commons Wikimedia


