Diferencia entre la excitación y el potencial de ionización
Diferencia clave: potencial de excitación vs ionización
El potencial de excitación de dos términos y el potencial de ionización están relacionados con la energía requerida para mover electrones, pero hay una diferencia entre ellos en función del destino del movimiento de electrones. En otras palabras, en estas dos situaciones, el destino del electrón después del movimiento es diferente. Se pueden identificar dos movimientos de electrones de esta manera. Los electrones pueden moverse a un nivel de energía más alto dentro del átomo o molécula o separarse del núcleo y alejarse del átomo. Ambos procesos requieren cantidades definidas de energía. Los electrones no pueden moverse a menos que la energía requerida no sea absorbida. El diferencia clave entre la excitación y el potencial de ionización es que El potencial de excitación es la energía requerida para saltar de un nivel de energía a otro mientras El potencial de ionización es la energía requerida para eliminar un electrón de un átomo.
Qué es Potencial de excitación?
Los átomos tienen niveles de energía que se llaman órbitas. Los electrones se mueven alrededor del núcleo en estas órbitas. Los electrones no pueden elegir órbitas arbitrarias; Se colocan en ciertas órbitas de acuerdo con sus niveles de energía y están restringidos para moverse o saltar a otro nivel de energía a menos que absorban la cantidad requerida de energía. Moverse de una órbita a otra después de absorber la cantidad requerida de energía se llama excitación y la energía absorbida para moverse de una órbita a otra se llama potencial de excitación o energía de excitación. 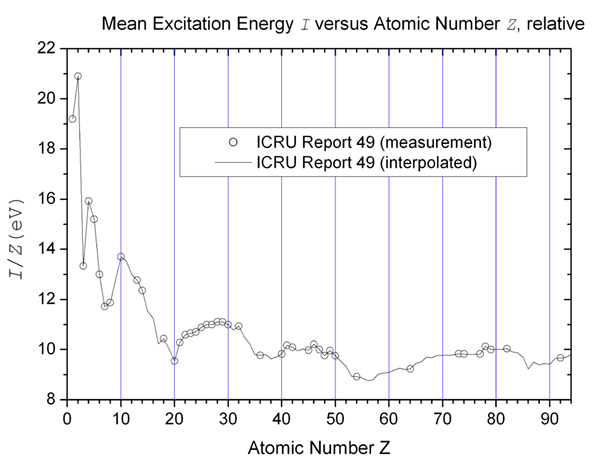
Qué es Potencial de ionización?
La ionización es el proceso de eliminar un electrón de la carcasa de valencia. En general, los electrones se unen al núcleo a través de fuertes fuerzas electrostáticas. Por lo tanto, se requiere energía para eliminar completamente un electrón del átomo. Esto se define como eliminar un electrón del átomo o la molécula a una distancia infinita. La energía requerida para este proceso se llama "energía de ionización"O" potencial de ionización ".
En otras palabras, es la diferencia de potencial entre el estado inicial, en el que el electrón está limitado al núcleo y el estado final en el que el electrón ya no está unido al núcleo donde descansa en el infinito.

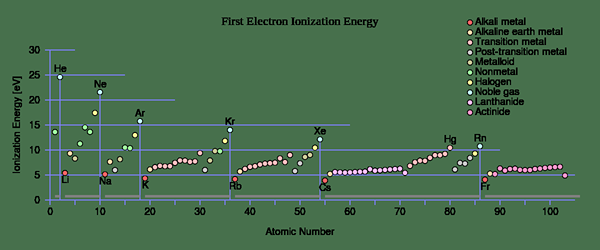
Tendencias periódicas para la energía de ionización (es decir) vs. número de protones
¿Cuál es la diferencia entre la excitación y el potencial de ionización??
Definición de potencial de excitación e ionización
Potencial de excitación:
La energía absorbida por un electrón para moverse de un nivel de energía a un nivel de energía más alto se llama "potencial de excitación" o energía de excitación. Esta suele ser la diferencia de energía entre el estado inicial y final.
Nota: Electron se mueve dentro del átomo, pero en diferentes niveles de energía.
Potencial de ionización:
La energía requerida para eliminar un electrón de un átomo se llama "potencial de ionización" o "energía de ionización". Esta es la diferencia de potencial entre dos estados donde un electrón está limitado al núcleo y el electrón se elimina del átomo. La energía cuando el electrón está a una distancia infinita se considera cero.
NOTA: Se elimina un electrón del átomo y no hay atracción con el núcleo cuando se elimina.
Cálculo:
Potencial de excitación:
Cuando un electrón salta del estado fundamental (n = 1) a otro (n = 2) nivel de energía, la energía correspondiente se llama 1calle potencial de excitación.
| 1calle potencial de excitación = energía (nivel n = 2) - Energía (N = 1 nivel) = -3.4 eV - (-13.6 eV) = 10.2 eV |
Cuando un electrón salta del estado fundamental (n = 1) a otro (n = 3) nivel de energía, la energía correspondiente se llama 2nd excitación de excitación.
| 2Dakota del Norte potencial de excitación = energía (nivel n = 3) - Energía (N = 1 nivel) = -1.5 eV - (-13.6 eV) = 12.1 eV |
Potencial de ionización:
Considere eliminar un electrón del nivel de energía n = 1. El potencial de ionización es la energía necesaria para eliminar un electrón del nivel n = 1 al infinito.
| Potencial de ionización = E infinidad - mi (N = 1 nivel)= 0 - (-13.6 eV) = 13.6 eV |
En los átomos, los electrones más ligeros se eliminan primero y el potencial de ionización aumenta gradualmente a medida que ioniza.
Imagen de cortesía:
"Potencial de excitación medio ”por HPaul - Trabajo propio. (Dominio público) a través de Wikimedia Commons
"Primera energía de ionización" del usuario: Sponk (CC BY-SA 3.0) Vía Commons


