Diferencia entre la primera y la segunda energía de ionización (I1e vs i2e)
Diferencia clave: primera vs segundo energía de ionización (I1e vs I2e)
Antes de analizar la diferencia entre la primera y la segunda energía de ionización, primero discutamos qué es la energía de ionización. En general, la energía de ionización se conoce como la energía requerida para eliminar un electrón de un átomo gaseoso o un ion. Dado que los electrones se sienten atraídos por el núcleo positivo, la energía debe ser suministrada para este proceso. Esto se considera como un proceso endotérmico. Las energías de ionización se expresan en kj mol-1. El diferencia clave Entre la primera y la segunda energía de ionización se explica mejor en sus definiciones; La energía absorbida por un átomo neutral y gaseoso para producir un ion cargado de +1 (para eliminar un electrón) se llama Primera energía de ionización mientras La energía absorbida por un ion gaseoso cargado positivamente (+1) para producir iones con una carga +2 se llama la segunda energía de ionización. La energía de ionización se calcula para 1 mol de átomos o iones. En otras palabras; La primera energía de ionización se relaciona con los átomos gaseosos neutros y la segunda energía de ionización se relaciona con los iones gaseosos con una carga (+1). La magnitud de la energía de ionización varía según la carga del núcleo, la distancia de la forma de electrones del núcleo y el número de electrones entre el núcleo y los electrones de la carcasa externa.
¿Cuál es la primera energía de ionización?1MI)?
La primera energía de ionización se define como la energía absorbida por 1 mol de los átomos gaseosos neutros para eliminar el electrón más flojo del átomo para producir 1 mol de iones gaseosos con carga +1. La magnitud de la primera energía de ionización aumenta a lo largo de un período en la tabla periódica y disminuye a lo largo de un grupo. La primera energía de ionización tiene periodicidad; Tiene el mismo patrón repetidamente a lo largo de la tabla periódica.
¿Qué es la segunda energía de ionización?2MI)?
La segunda energía de ionización se define como la energía absorbida por 1 mol de iones gaseosos cargados positivamente para producir 1 mol de iones gaseosos con una carga de +2, eliminando el electrones unidos libremente del ion +1. La segunda energía de ionización también muestra periodicidad. 
¿Cuál es la diferencia entre la primera y la segunda energía de ionización (i1E y yo2MI)?
Definicion de Primera y segunda energía de ionización
Primera energía de ionización (yo1MI): La energía requerida para eliminar el electrón más unido de 1 mol de átomos gaseosos para producir 1 mol de iones gaseosos con una carga positiva (+1).
X (gramo) X+ (gramo) + mi-
(1 mol) (1 mol) (1 mol)
Segunda energía de ionización (yo2MI): La energía requerida para eliminar el electrón más unido de 1 mol de iones gaseosos con una carga +1 para producir mol de iones gaseosos con carga +2.
X+ (gramo) X2+ (gramo) + mi-
(1 mol) (1 mol) (1 mol)
Características de la primera y segunda energía de ionización
Requisito de energía
Por lo general, expulsar el primer electrón desde un átomo gaseoso de estado fundamental es más fácil que expulsar el segundo electrón de un ion cargado positivamente. Por lo tanto, la La primera energía de ionización es menor que la segunda energía de ionización y la diferencia de energía entre la primera y la segunda energía de ionización es significativamente grande.
| Elemento | Primera energía de ionización (yo1MI) /KJ mol-1 | Segunda energía de ionización (yo2mi) / kj mol-1 |
| Hidrógeno (H) | 1312 | |
| Helio (él) | 2372 | 5250 |
| Litio (Li) | 520 | 7292 |
| Berilio (be) | 899 | 1757 |
| Boro (b) | 800 | 2426 |
| Carbono (c) | 1086 | 2352 |
| Nitrógeno (N) | 1402 | 2855 |
| Oxígeno (O) | 1314 | 3388 |
| Flúor (f) | 680 | 3375 |
| Neón (NE) | 2080 | 3963 |
| Sodio (NA) | 496 | 4563 |
| Magnesio (mg) | 737 | 1450 |
Tendencias de la energía de ionización en la tabla periódica
Primera energía de ionización (yo1MI): Los primeros valores de energía de ionización de los átomos en cada período muestran la misma variación. La magnitud siempre es menor que los segundos valores de energía de ionización
Segunda energía de ionización (yo2MI): Los valores de energía de la segunda ionización de los átomos en cada período muestran la misma variación; Esos valores son siempre más altos que los primeros valores de energía de ionización.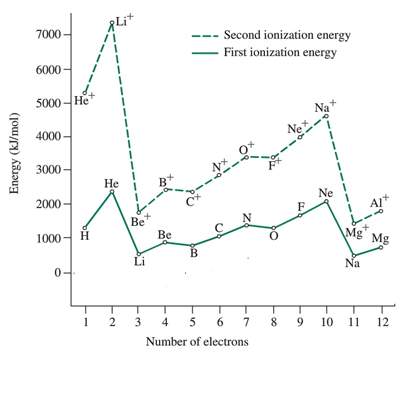 Imagen de cortesía:
Imagen de cortesía:


