Diferencia entre el primer orden y la reacción de pseudo de primer orden
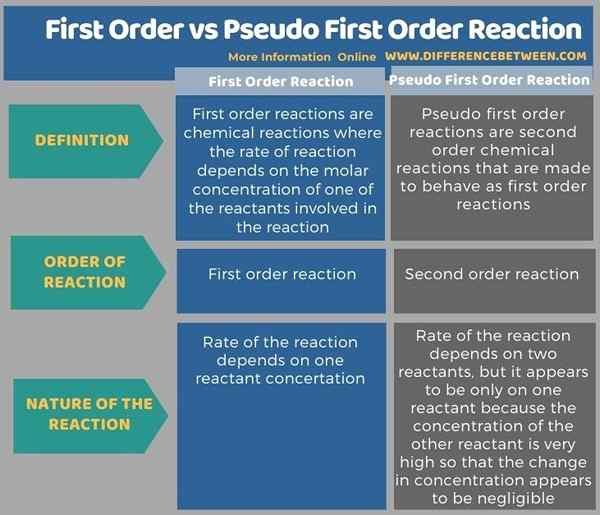
El diferencia clave Entre el primer orden y la reacción de pseudo de primer orden es que Las reacciones de primer orden proceden a una velocidad que depende linealmente solo de una concentración de reactivos, mientras que las reacciones de Pseudo de primer orden son reacciones de segundo orden que se hacen comportarse como reacciones de primer orden.
El término "pseudo" significa "no genuino". Por lo tanto, una reacción pseudo tiene las propiedades de un tipo particular de reacciones químicas, pero la reacción en realidad es una reacción química completamente diferente.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Cuáles son las reacciones de primer orden?
3. ¿Cuáles son las reacciones de pseudo de primer orden?
4. Comparación de lado a lado - Reacción de primer orden de primer orden vs pseudo en forma tabular
5. Resumen
¿Cuáles son las reacciones de primer orden??
Las reacciones de primer orden son reacciones químicas en las que la velocidad de reacción depende de la concentración molar de uno de los reactivos que está involucrado en la reacción. Según la definición de "el orden de reacción", la suma de los poderes a los que se elevan las concentraciones reactivas en la ecuación de la ley de velocidad siempre será 1 para una reacción de primer orden. Puede haber un solo reactivo que participe en estas reacciones o más de un reactivo. En la primera situación, la concentración de ese solo reactivo determina la velocidad de la reacción. En la segunda situación, uno de los reactivos que participan en la reacción determinará la velocidad de la reacción.
Para comprender este concepto, consideremos la reacción de descomposición de N2O5, que forma no2 y o2 gases como productos. Como solo tiene un reactivo, podemos escribir la reacción y la ecuación de velocidad de la siguiente manera.
2n2O5 (g) → 4NO2 (g) + O2 (g)
Tasa = k [n2O5 (g)]metro
En esta ecuación de velocidad, k es la constante de velocidad para esta reacción y M es el orden de la reacción. Entonces las determinaciones experimentales deberían dar el valor de M como 1. Por lo tanto, podemos identificar que esta es una reacción de primer orden.
¿Cuáles son las reacciones de pseudo de primer orden??
Las reacciones de primer orden de seudo son reacciones químicas de segundo orden que se hacen para comportarse como reacciones de primer orden. Por lo tanto, estas reacciones también pueden llamarse reacciones bimoleculares. Este tipo de reacciones ocurre cuando un material de reacción ocurre un gran exceso de concentración en la mezcla de reacción y, por lo tanto, parece una concentración constante en comparación con las concentraciones de otras sustancias.
Se puede administrar una reacción de segundo orden de muestra de la siguiente manera:
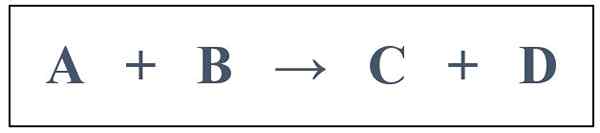
En esta reacción, la velocidad de la reacción depende tanto de la concentración "A" como de la concentración de "B". Pero la concentración de "A" es muy alta en comparación con la concentración de "B", y el cambio en la concentración de "A" durante la progresión de la reacción parece ser insignificante. Entonces podemos predecir el orden de esta reacción como 1 porque el cambio en la concertación aparece solo para "B". Sin embargo, la reacción es en realidad una reacción de segundo orden porque la velocidad de la reacción depende de ambos reactivos. Por lo tanto, podemos clasificar este tipo de reacciones como reacciones de Pseudo First Order.
¿Cuál es la diferencia entre el primer orden y la reacción de pseudo de primer orden??
Las reacciones de primer orden y las reacciones de pseudo de primer orden son diferentes entre sí. La diferencia clave entre el primer orden y la reacción de Pseudo de primer orden es que las reacciones de primer orden proceden a una velocidad que depende linealmente solo de una concentración de reactivos, mientras que las reacciones de pseudo de primer orden son reacciones de segundo orden que se hacen para comportarse como reacciones de primer orden.
A continuación se muestra una tabulación resumida de la diferencia entre el primer orden y la reacción de pseudo de primer orden.

Resumen -Reacción de primer orden de primer orden vs pseudo
Las reacciones de primer orden y las reacciones de pseudo de primer orden son diferentes entre sí. La diferencia clave entre el primer orden y la reacción de Pseudo de primer orden es que las reacciones de primer orden proceden a una velocidad que depende linealmente solo de una concentración de reactivos, mientras que las reacciones de pseudo de primer orden son reacciones de segundo orden que se hacen para comportarse como reacciones de primer orden.
Referencia:
1. "Reacción de primer orden de pseudo - Ley de velocidad, orden de reacción y ejemplos." Byjus, 12 de agosto. 2020, disponible aquí.


