Diferencia entre flúor y fluoruro

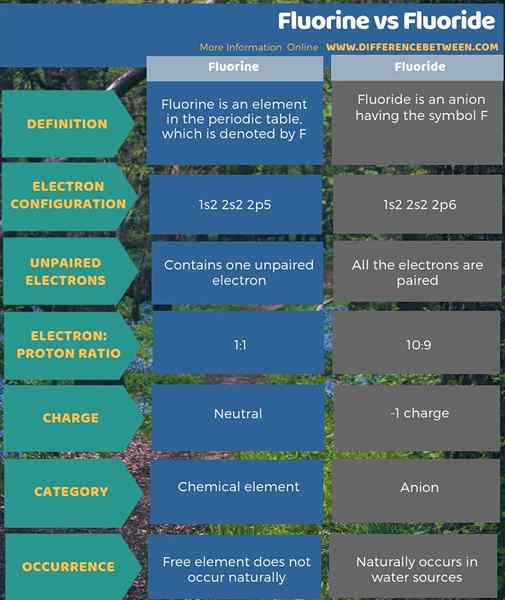
El diferencia clave entre el fluorine y el fluoruro es que El flúor es neutro, mientras que el fluoruro se carga negativamente.
Los elementos en la tabla periódica, excepto los gases nobles, no son estables. Por lo tanto, los elementos intentan reaccionar con otros elementos para obtener la configuración de electrones de gas noble y lograr la estabilidad. Fluorine es un elemento que también tiene que obtener un electrón para lograr la configuración de electrones del gas noble, neón. Todos los metales reaccionan con flúor, formando fluoruros. Por lo tanto, hay una diferencia entre el fluorino y el fluoruro dependiendo de sus propiedades físicas y químicas debido al cambio de un electrón.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el flúor?
3. ¿Qué es el fluoruro?
4. Comparación de lado a lado: fluorino vs fluoruro en forma tabular
5. Resumen
¿Qué es el flúor??
El flúor es un elemento en la tabla periódica, que se denota por F. Es un halógeno (17º grupo) en el segundo período de la tabla periódica. El número atómico de flúor es 9; Por lo tanto, tiene nueve protones y nueve electrones. Su configuración de electrones se escribe como 1S2 2S2 2P5. Dado que el PUBLEL P debe tener 6 electrones para obtener la configuración de electrones de gas noble, Fluorine tiene la capacidad de atraer un electrón. Según la escala Pauling, el flúor tiene la mayor electronegatividad en la tabla periódica, que es aproximadamente 4.
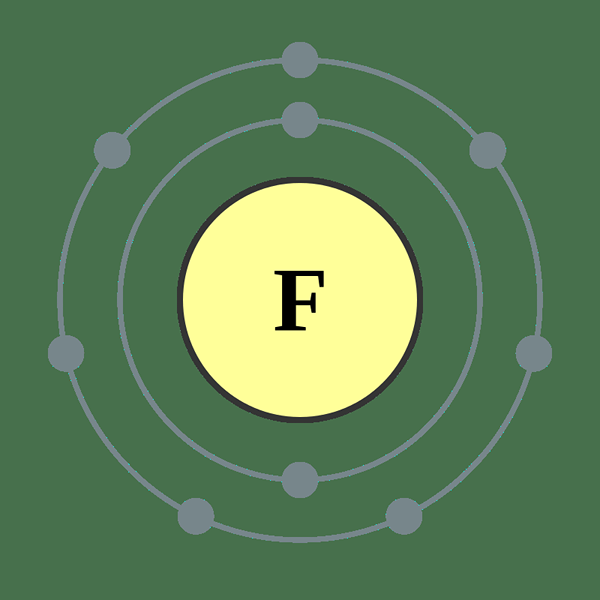
Figura 01: átomo de flúor
La masa atómica de flúor es 18.9984 amu. A temperatura ambiente, el flúor existe como una molécula diatómica (F2). F2 es un gas de color de color verde amarillo pálido y tiene un punto de fusión de -219 ° C y un punto de ebullición de -188 ° C. Entre los isótopos de flúor, F-17 no es un isótopo estable y tiene una vida media de 1.8 horas. Pero F-19 es un isótopo estable. La abundancia de F-19 en la Tierra es del 100%. El flúor puede oxidar el oxígeno y su estado de oxidación es -1.
El gas flúor es más denso que el aire y también se puede licuar y solidificar. Es altamente reactivo, y esto se debe a su alta electronegatividad y un enlace débil fluorino-fluorino. Además, las reacciones de esta especie química con la mayoría de las otras moléculas son rápidas. Debido a la reactividad, no se encuentra como un elemento libre.
¿Qué es el fluoruro??
El fluoruro es el anión que se forma cuando el flúor abstrae un electrón de otro elemento electropositivo. Podemos representarlo por el símbolo F-. Es un ion monovalente con -1 carga. Por lo tanto, tiene 10 electrones y nueve protones. Además, la configuración electrónica de fluoruro es 1s2 2S2 2P6.

Figura 02: Fluoruro que contiene pasta de dientes
El fluoruro existe en compuestos iónicos como fluoruro de sodio, fluoruro de calcio (fluorita) y HF. También existe naturalmente en fuentes de agua. Se sabe que este ion ayuda a prevenir la caries dental; Por lo tanto, se agrega a la pasta de dientes.
¿Cuál es la diferencia entre fluorino y fluoruro??
El flúor es un elemento químico, mientras que el fluoruro es el anión que forma. La diferencia clave entre el fluorino y el fluoruro es que el fluorino es neutro, mientras que el fluoruro se carga negativamente. El flúor es un elemento en la tabla periódica que se denota por F, mientras que el fluoruro es un anión que tiene el símbolo F-. Además, no hay electrones no apareados en el fluoruro, pero hay un electrón no apareado en el átomo de flúor. Otra diferencia entre el fluorino y el fluoruro es que el elemento libre de flúor no ocurre naturalmente, pero el fluoruro ocurre naturalmente en las fuentes de agua.
Resumen -Fluorine vs fluoruro
Básicamente, el flúor es un elemento químico, mientras que el fluoruro es el anión que forma. La diferencia clave entre el fluorino y el fluoruro es que el fluorino es neutro, mientras que el fluoruro se carga negativamente.
Referencia:
1. Miller, Bruce G. “El efecto del uso del carbón en la salud humana y el medio ambiente."Clean Coal Engineering Technology, 2017, PP. 105-144., doi: 10.1016/b978-0-12-811365-3.00003-x.
Imagen de cortesía:
1. "Electron Shell 009 Fluorine - No etiqueta" de Pumbaa (trabajo original de Greg Robson) - Archivo: Electron Shell 009 Fluorine.SVG, (CC BY-SA 2.0 Reino Unido) Vía Commons Wikimedia
2. "Pasta de dientes" de William Warby (CC por 2.0) a través de Flickr


