Diferencia entre el cargo formal y el estado de oxidación
El diferencia clave entre el cargo formal y el estado de oxidación es que La carga formal es la carga de un átomo en una molécula que calculamos suponiendo que los electrones en los enlaces químicos se comparten por igual entre los átomos, mientras que el estado de oxidación es el número de electrones que un átomo pierde o gana o comparte con otro átomo.
La carga formal y el estado de oxidación son términos diferentes, aunque generalmente suponemos que son los mismos. La carga formal determina el número de electrones que ocurren alrededor de un átomo de una molécula, mientras que el estado de oxidación determina el número de electrones intercambiados entre átomos durante la formación de una molécula.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el cargo formal?
3. ¿Qué es el estado de oxidación?
4. Comparación de lado a lado - Estado formal de carga versus oxidación en forma tabular
5. Resumen
¿Qué es el cargo formal??
La carga formal es la carga de un átomo en una molécula que calculamos suponiendo que los electrones en los enlaces químicos se comparten por igual entre átomos. Por lo tanto, al determinar la carga formal, estamos comparando el número de electrones alrededor de un átomo neutro y el número de electrones alrededor de ese átomo cuando está en una molécula. En esta determinación de la carga formal, tenemos que asignar los electrones de la molécula a átomos individuales. Aquí, también debemos considerar los siguientes requisitos;
- Tenemos que asignar electrones no condenados al átomo en el que ocurren los electrones no vinculantes
- Tenemos que dividir los electrones de unión por igual entre los átomos compartidos
La relación matemática para este cálculo es la siguiente:
Carga formal = (número de electrones de valencia en un átomo neutro) - (número de electrones de par solitario) - (1/2*electrones de par de enlace)
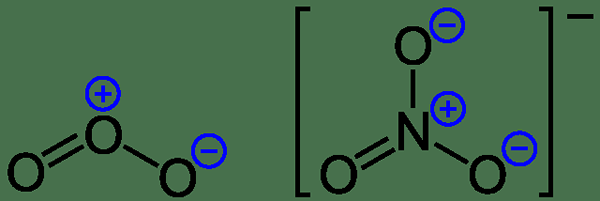
Figura 1: Cargas formales sobre el anión de ozono y nitrato
Consideremos un ejemplo para comprender este fenómeno. Para la molécula de amoníaco, hay tres enlaces N-H y un par solitario de electrones en el átomo de nitrógeno. Entonces, ¿cuándo puede calcular los siguientes;
Carga formal de n = 5 - 2 - 1/2*6 = 0
Carga formal de H = 1 - 0 - 1/2*2 = 0
¿Qué es el estado de oxidación??
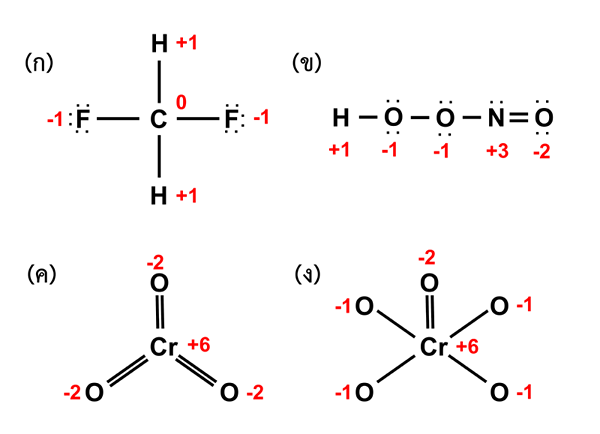
El estado de oxidación es el número de electrones que un átomo en particular puede perder, ganar o compartir con otro átomo. Este término se aplica a cualquier elemento químico en moléculas (el término número de oxidación se aplica principalmente a los átomos metálicos centrales de los complejos de coordinación, aunque usamos estos términos indistintamente). El estado de oxidación en realidad da el grado de oxidación de un átomo en un compuesto. Siempre debemos dar el estado de oxidación como un número entero, y está representado en números hindúes-árabe, incluida la carga del átomo. Por ejemplo, el estado de oxidación del hierro en FEO es +2.

Figura 02: Estados de oxidación de los átomos en diferentes moléculas
Consejos para la determinación del estado de oxidación:
- El estado de oxidación de un solo elemento es cero (esto incluye las moléculas hechas de un solo elemento también).
- La carga total de una molécula o ion es la suma de las cargas de cada átomo.
- El estado de oxidación de los metales alcalinos es siempre +1, y para los metales de la tierra alcalina es +2.
- Mientras tanto, el estado de oxidación del flúor es siempre -1.
- Además, el estado de oxidación del hidrógeno suele ser +1. Pero a veces es -1 (cuando se une a los metales de la Tierra Alkali o Alkali.)
- Además, en general, el estado de oxidación del oxígeno es -2 (pero en los peróxidos y super -óxidos puede variar).
- El átomo más electronegativo en una molécula obtiene la carga negativa, y el otro obtiene la carga positiva.
El estado de oxidación es muy útil para la determinación de productos en reacciones redox. Las reacciones redox son reacciones químicas que incluyen el intercambio de electrones entre los átomos. En las reacciones redox, dos medias reacciones ocurren paralelas simultáneamente. Uno es la reacción de oxidación, y la otra es la reacción de reducción. La reacción de oxidación implica el aumento del estado de oxidación de un átomo, mientras que la reacción de reducción implica la disminución del estado de oxidación de un átomo.
¿Cuál es la diferencia entre el cargo formal y el estado de oxidación??
La diferencia clave entre la carga formal y el estado de oxidación es que la carga formal es la carga de un átomo en una molécula que calculamos suponiendo que los electrones en los enlaces químicos se comparten por igual entre los átomos, mientras que el estado de oxidación es el número de electrones que pierde un átomo o ganan o comparte con otro átomo. Por ejemplo, la carga formal del átomo de nitrógeno en la molécula de amoníaco es 0, mientras que el estado de oxidación es +3.
A continuación, la infografía resume la diferencia entre la carga formal y el estado de oxidación.

Resumen -Cargo formal vs oxidación
La carga formal y el estado de oxidación son términos diferentes, aunque algunas personas asumen que son los mismos. La diferencia clave entre la carga formal y el estado de oxidación es que la carga formal es la carga de un átomo en una molécula que calculamos suponiendo que los electrones en los enlaces químicos se comparten por igual entre los átomos, mientras que el estado de oxidación es el número de electrones que pierde un átomo o ganan o comparte con otro átomo.
Referencia:
1. "2.3: cargos formales." Bibliotecas de química, Libretexts, 25 de julio de 2019, disponible aquí.
Imagen de cortesía:
1. "Principio de carga formal V.1 ”por Jü - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Asignaciones de estado de oxidación" de Saranphong Yimklan - Trabajo propio (dominio público) a través de Commons Wikimedia


