Diferencia entre la masa de la unidad de fórmula y la masa molecular
Diferencia clave: fórmula Masa unitaria vs masa molecular
La masa de la unidad de fórmula o la masa de fórmula de un compuesto es la masa de fórmula empírica de ese compuesto. La fórmula empírica de un compuesto es la fórmula química que da la relación entre los diferentes átomos presentes en ese compuesto en pequeños números enteros. En otras palabras, es la menor relación entre los elementos químicos en un compuesto. No da el número real de cada elemento químico. Cuando se mide la masa de esta fórmula, se conoce como masa de la unidad de fórmula. La masa molecular de un compuesto es la masa de una molécula de una sustancia particular. La mayoría de las veces, los términos masa molar y masa molecular se usan indistintamente, aunque son términos distintos. La masa molar es la masa de un mol de sustancia, mientras que la masa molecular no es la masa de un topo de una sustancia. Para moléculas simples, la masa de fórmula y la masa molecular son las mismas. Pero para compuestos complejos, hay una gran diferencia entre dos valores. El diferencia clave entre la masa de la unidad de fórmula y la masa molecular es que El valor de la masa de la unidad de fórmula siempre es más pequeño o similar a la masa molecular de la misma sustancia, mientras que el valor de la masa molecular es siempre mayor o similar a la masa de la unidad de fórmula de la misma sustancia.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la masa de la unidad de fórmula?
3. ¿Qué es la masa molecular?
4. Similitudes entre la masa de la unidad de fórmula y la masa molecular
5. Comparación de lado a lado: masa de la unidad de fórmula frente a masa molecular en forma tabular
6. Resumen
¿Qué es la masa de la unidad de fórmula??
La masa de la unidad de fórmula o la masa de fórmula es la masa de la fórmula empírica de una sustancia particular. Esto significa que es la suma de las masas atómicas de los elementos químicos presentes en la fórmula empírica. La fórmula empírica es la fórmula química de una sustancia que da la relación más simple entre los elementos químicos presentes en una sustancia. Por ejemplo, la fórmula empírica para c6H12O6 (glucosa) es CH2O. Consideremos algunos ejemplos para comprender el concepto.
Cálculo de la masa de la unidad de fórmula
Masa de la unidad de fórmula de compuestos simples
Para compuestos simples como NaCl (cloruro de sodio), la fórmula empírica y la fórmula molecular son las mismas. El valor de la masa de la unidad de fórmula es,
(Masa atómica de Na) + (masa atómica de cl) = (23 + 35.5) Amu = 58.5 amu
Masa de la unidad de fórmula de compuestos complejos
Para compuestos complejos como C11H22O11 (sacarosa), la fórmula empírica es CH2 Entonces la masa de la unidad de fórmula es,
(Masa atómica de c) + 2 (masa atómica de h) + (masa atómica de o) = (12 + 2 × 1 + 16) amu = 30 amu.
Para los compuestos de polímero, la masa de la unidad de fórmula es la masa de una unidad repetida. Un polímero es una macromolécula que está hecha de muchos números de pequeños compuestos conocidos como monómeros. Una unidad repetida representa el monómero o los monómeros utilizados para producir el compuesto de polímero. Por lo tanto, es equivalente a la fórmula empírica de un compuesto complejo.
¿Qué es la masa molecular??
La masa molecular es la masa de una molécula de una sustancia particular. También se conoce como el peso molecular. El peso molecular se calcula como la suma de la masa atómica de todos los elementos químicos presentes en la molécula considerando las relaciones reales entre esos elementos.
Por lo tanto, para compuestos grandes y complejos, el valor de la masa de la unidad de fórmula siempre es mayor que el de la masa molecular. Pero para moléculas pequeñas y simples, ambas pueden ser lo mismo.
Cálculo de la masa molecular
Consideremos algunos ejemplos para comprender el método de cálculo.
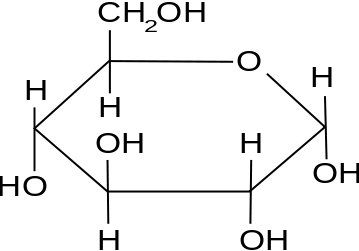
Ejemplo: glucosa
La fórmula química de la glucosa es C6H12O6. Por lo tanto, el peso molecular de la glucosa es,
6 (masa atómica de C) + 12 (masa atómica de H) + 6 (masa atómica de O)
= 6 (12 amu) + 12 (1 amu) + 6 (16 amu)
= (72 + 12 + 96) Amu
= 180 amu.

Figura 01: molécula de glucosa
Ejemplo: carbonato de calcio
La fórmula química del carbonato de calcio es el caCo3 , que también es la fórmula empírica de ese compuesto. Por lo tanto, el peso molecular del carbonato de calcio es,
(Masa atómica de Ca) + (masa atómica de C) + 3 (masa atómica de O)
= (40 + 12 + 3 x 16) amu
= 100 amu
¿Cuáles son las similitudes entre la masa de la unidad de fórmula y la masa molecular??
- Tanto la masa de la unidad de fórmula como la masa molecular son mediciones de peso de las sustancias.
- Tanto la masa de la unidad de fórmula como la masa molecular tienen la misma unidad de medición.
¿Cuál es la diferencia entre la masa de la unidad de fórmula y la masa molecular??
Masa de la unidad de fórmula vs masa molecular | |
| La masa de la unidad de fórmula o la masa de fórmula es la masa de la fórmula empírica de una sustancia particular. | La masa molecular es la masa de una molécula en una sustancia particular. |
| Valor | |
| El valor de la masa de la unidad de fórmula siempre es más pequeño o similar a la masa molecular de la misma sustancia. | El valor de la masa molecular es siempre más grande o similar a la masa de la unidad de fórmula de la misma sustancia. |
Resumen -Fórmula Masa unitaria vs masa molecular
La masa de la unidad de fórmula es la masa de la fórmula empírica de una sustancia particular. La masa molecular de una sustancia es la masa real de una molécula de una sustancia particular. La diferencia entre la masa de la unidad de fórmula y la masa molecular es que el valor de la masa de la unidad de fórmula siempre es más pequeño o similar a la masa molecular de la misma sustancia, mientras que el valor de la masa molecular es siempre mayor o similar a la masa de la unidad de fórmula de la misma sustancia.
Referencia:
1.Helmenstine, Anne Marie, D. "Masa de fórmula versus masa molecular."Thinkco, Mar. 25, 2017. Disponible aquí
2."Masa molecular."Wikipedia, Fundación Wikimedia, 25 de febrero. 2018. Disponible aquí
3."Formula empírica."Wikipedia, Fundación Wikimedia, 18 de febrero. 2018. Disponible aquí
Imagen de cortesía:
1.'Alpha-D-Glucose Haworth'by Masur (dominio público) a través de Commons Wikimedia


