Diferencia entre energía libre y energía de activación
El diferencia clave entre la energía libre y la energía de activación es que La energía libre es la cantidad de Energía disponible para que un sistema termodinámico realice un trabajo termodinámico, mientras que la energía de activación de una reacción química es la barrera de energía que debe superarse para obtener productos de la reacción.
La energía libre y la energía de activación son dos términos diferentes que también tienen diferentes aplicaciones. El término energía libre se utiliza con respecto a los sistemas termodinámicos en la química física, mientras que el término energía de activación se usa principalmente con respecto a las reacciones químicas en la bioquímica.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la energía libre?
3. ¿Qué es la energía de activación?
4. Comparación de lado a lado: energía libre versus energía de activación en forma tabular
5. Resumen
¿Qué es la energía libre??
La energía libre es la cantidad de energía disponible para que un sistema termodinámico realice un trabajo termodinámico. La energía libre tiene las dimensiones de la energía. El valor de la energía libre de un sistema termodinámico está determinado por el estado actual del sistema, no por su historia. Hay dos tipos principales de energía libre a menudo discutidas en termodinámica: energía libre de Helmholtz y energía libre de Gibbs.
La energía libre de Helmholtz es la energía que está disponible en un sistema termodinámico cerrado para realizar un trabajo termodinámico a temperatura y volumen constantes. Por lo tanto, el valor negativo de la energía Helmholtz indica el trabajo máximo que un sistema termodinámico puede realizar manteniendo su volumen constante. Para mantener constante el volumen, parte del trabajo termodinámico total se realiza como trabajo límite (para mantener el límite del sistema tal como está).
La energía libre de Gibbs es la energía que está disponible en un sistema termodinámico cerrado para realizar un trabajo termodinámico a temperatura y presión constantes. El volumen del sistema puede variar. La energía libre se denota por G.
¿Qué es la energía de activación??
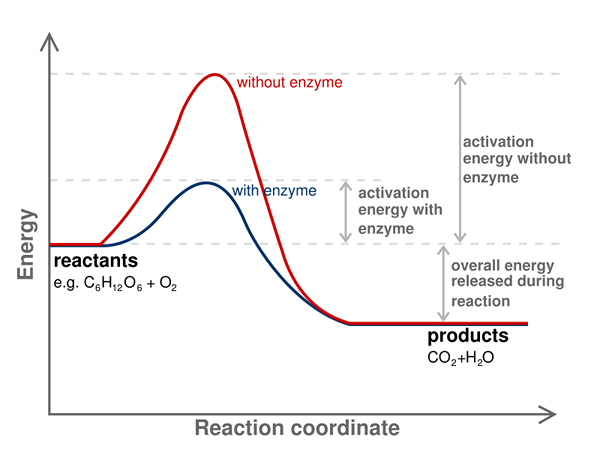
La energía de activación de una reacción química es la barrera de energía que debe superarse para obtener productos de la reacción. En otras palabras, es la energía mínima requerida para que un reactivo se convierta en un producto. Siempre es necesario proporcionar energía de activación para comenzar una reacción química.
Denotamos energía de activación como ea o ae; Lo medimos por la unidad KJ/Mol. Además, la energía de activación se considera la energía mínima requerida para formar el intermedio con la energía potencial más alta en una reacción química. Algunas reacciones químicas tienen una progresión lenta y tienen lugar a través de dos o más pasos. Aquí, los intermedios se forman y luego se reorganizan para formar el producto final. Por lo tanto, la energía requerida para comenzar esa reacción es la energía requerida para formar el intermedio con la energía potencial más alta.

Además, los catalizadores pueden reducir la energía de activación. Por lo tanto, los catalizadores a menudo se usan para superar la barrera de energía y dejar que la reacción química progrese. Las enzimas son catalizadores biológicos que pueden disminuir la energía de activación de la reacción que tiene lugar en los tejidos.
¿Cuál es la diferencia entre energía libre y energía de activación??
La energía libre y la energía de activación son dos términos diferentes que también tienen diferentes aplicaciones. La diferencia clave entre la energía libre y la energía de activación es que la energía libre es la cantidad de energía disponible para que un sistema termodinámico realice un trabajo termodinámico, mientras que la energía de activación de una reacción química es la barrera de energía que debe superarse para obtener productos de la reacción.
A continuación se muestra el resumen de la diferencia entre energía libre y energía de activación en forma tabular.
Resumen: energía libre versus energía de activación
La energía libre y la energía de activación son dos términos diferentes que tienen diferentes aplicaciones. La diferencia clave entre la energía libre y la energía de activación es que la energía libre es la cantidad de energía disponible para que un sistema termodinámico realice un trabajo termodinámico, mientras que la energía de activación de una reacción química es la barrera de energía que debe superarse para obtener productos de la reacción.
Referencia:
1. Helmenstine, Anne Marie. "Definición de energía de activación en química."Thinkco, agosto. 27, 2020, disponible aquí.
Imagen de cortesía:
1. "Activación2 actualizado" cargado originalmente por Jerry Crimson Mann, vectorizado por tutmosis, corregido por Fvasconcellos - en: Image: Activation2.PNG (CC BY-SA 3.0) a través de Commons Wikimedia


