Diferencia entre el radical libre y el ion
El diferencia clave entre el radical libre y el ion es que el Los radicales libres tienen uno o más electrón no apareados, pero los iones han emparejado electrones.
Podemos explicar la diferencia entre el radical libre y el ion a partir de las propiedades básicas de un ion y un radical libre. Un ion puede ocurrir como una molécula o átomo con una carga (positiva o negativa) debido a la pérdida o ganancia de un electrón. Los iones contienen una carga negativa debido a la ganancia de un electrón y contienen una carga positiva debido a la pérdida de un electrón. Los iones pueden ocurrir como especies químicas simples o múltiples, dependiendo del número de electrones obtenidos o perdidos. Los radicales libres son moléculas o átomos que tienen al menos un electrón no apareado. Este artículo trata sobre la diferencia entre el radical libre y el ion, incluidas sus características especiales.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el radical libre?
3. Que es ion
4. Comparación de lado a lado - Radical libre vs ion en forma tabular
5. Resumen
¿Qué es el radical libre??
Un radical libre es un átomo o un grupo de átomos que contienen uno o más electrones no apareados. Son altamente reactivos debido a la presencia de un electrón no apareado. Los radicales libres son muy inestables e intentan ganar estabilidad aceptando el electrón necesario. Reaccionan con otros compuestos químicos capturando el electrón necesario. Los radicales libres son intermedios importantes en los procesos naturales. Podemos denotar radicales libres por un punto superíndice a la derecha. Por ejemplo, H., CL., HO., H3C.
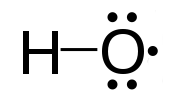
Figura 01: el radical hidroxilo
Los radicales libres de larga vida se encuentran en tres categorías: radicales estables, radicales persistentes y di-radicales.
- Radicales estables: El principal ejemplo de un radical estable es el oxígeno molecular O2. Los radicales orgánicos que contienen el sistema π conjugado pueden vivir mucho.
- Radicales persistentes: Son de larga duración debido al hacinamiento estérico alrededor del centro radical y los hacen físicamente difíciles de reaccionar con otra molécula.
- Di-radicals: Algunas moléculas tienen dos centros radicales, los nombramos como di-radicales. Oxígeno molecular naturalmente (oxígeno atmosférico) existe como un diradical.
Que es ion?
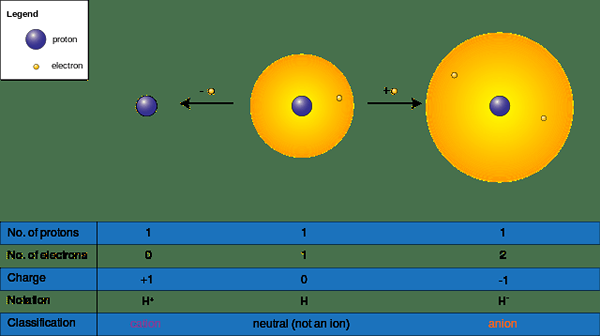
Los iones pueden formarse cuando una especie química gana o pierde electrones en reacciones químicas; Tienen una carga positiva (+) o negativa (-). Esos obtienen una carga negativa aceptando un electrón y carga positiva donando electrones a una molécula de deficiencia de electrones o un elemento. Aceptar o donar electrones afectan directamente el tamaño del ion; Cambia el tamaño molecular dramáticamente. Nombramos un átomo o un grupo de átomos sin una carga negativa o positiva como "neutral"; Para convertirse en un átomo neutro o una molécula, el número de protones debe ser el mismo que una serie de electrones.
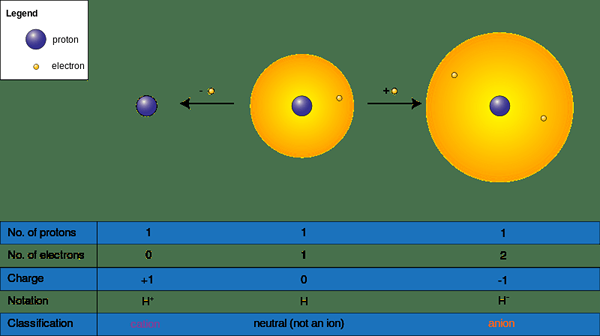
Figura 02: formación y formación de aniones
Por lo tanto, hay dos formas de iones de la siguiente manera.
- Cationes o (+) iones - A menudo, los metales se encuentran en esta categoría ya que los metales pierden electrones para volverse positivos (+) (NA+, Licenciado en Letras2+, California2+, Alabama3+)
- Iones aniones (-) - A menudo, los no metales se encuentran en esta categoría, ya que los no metales ganan electrones para volverse negativos (-) cargados (CL-, S2-, O2-, BR-)
¿Cuál es la diferencia entre el radical libre y el ion??
La diferencia clave entre el radical libre y el ion es que los radicales libres tienen uno o más electrón no apareados, pero los iones han emparejado electrones. Por lo tanto, los radicales libres son muy inestables, mientras que los iones son relativamente estables. Por lo tanto, esta también es una diferencia significativa entre el radical libre y el ion. Sin embargo, los radicales pueden existir por sí mismos, mientras que la mayoría de los iones se combinan con iones con carga opuesta. Al considerar más sobre su estabilidad, los radicales libres se están estables al aceptar electrones, pero los iones son estables cuando forman complejos con compuestos con carga opuesta.
Otra diferencia importante entre el radical libre y el ion es que los iones siempre tienen una carga, pero los radicales libres no son especies cargadas incluso si tienen electrones no apareados. Esta diferencia surge porque, en un ion, el número total de electrones siempre no es igual al número de protones en el núcleo, mientras que en un radical libre, el número de electrones es igual al número de protones.
La siguiente infografía proporciona más detalles sobre la diferencia entre el radical libre y el ion.
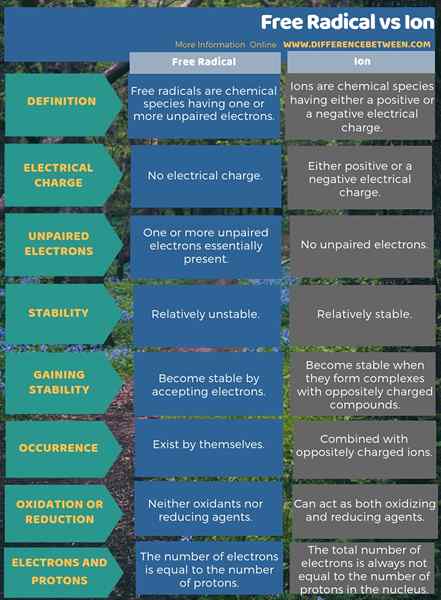
Resumen -Radical Free Vs Ion
Podemos describir tanto los términos, radicales y iones libres, utilizando el número de electrones que pertenecen a una especie en particular. Aquí, la diferencia más significativa entre los radicales y los iones libres es que los radicales libres tienen electrones no apareados pero, los iones han emparejado electrones. Por lo tanto, los radicales libres son más reactivos. Por otro lado, los iones se vuelven químicamente estables al formar compuestos con iones/moléculas cargadas opuestas.
Referencia:
1. "Radical (Química)."Wikipedia, Fundación Wikimedia, 8 de octubre. 2018. Disponible aquí
2. "Ion."Wikipedia, Fundación Wikimedia, 16 de octubre. 2018. Disponible aquí
Imagen de cortesía:
1."Radical hidroxilo" de Smokeyjoe - Trabajo propio, (CC By -SA 4.0) a través de Commons Wikimedia
2."Iones" de Jkwchui - trabajo propio, (cc by -sa 3.0) a través de Commons Wikimedia


