Diferencia entre la depresión del punto de congelación y la elevación del punto de ebullición
Diferencia clave: congelación Depresión de punto frente a la elevación del punto de ebullición
La depresión del punto de congelación hace que una solución se congele a una temperatura más baja que el punto de congelación del solvente puro debido a la adición de solutos. La elevación del punto de ebullición hace que una solución hervir a una temperatura más alta que el punto de ebullición del solvente puro debido a la adición de solutos. Por lo tanto, la diferencia clave Entre la depresión del punto de congelación y la elevación del punto de ebullición es que el La depresión del punto de congelación disminuye el punto de congelación de una solución, mientras que la elevación del punto de ebullición aumenta el punto de ebullición de una solución.
La depresión del punto de congelación y la elevación del punto de ebullición son propiedades de coligeración de la materia. Esto significa que dependen solo de la cantidad de solutos, no de la naturaleza del soluto.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la depresión del punto de congelación?
3. ¿Qué es la elevación del punto de ebullición?
4. Comparación lado a lado: depresión del punto de congelación frente a la elevación del punto de ebullición en forma tabular
5. Resumen
¿Qué es la depresión del punto de congelación??
La depresión del punto de congelación es la disminución del punto de congelación de un solvente debido a la adición de un soluto al solvente. Es una propiedad de coligeración. Esto significa que la depresión del punto de congelación depende solo de la cantidad de solutos, no de la naturaleza del soluto. Cuando se ha producido depresión del punto de congelación, el punto de congelación del solvente disminuye a un valor más bajo que el del solvente puro. La depresión del punto de congelación es la razón por la cual el agua de mar permanece en estado líquido incluso a 0 ° C (el punto de congelación del agua pura). La depresión del punto de congelación se puede administrar a continuación.
ΔtF = TF (solvente) - TF (solución)
O
ΔtF = KFmetro
En esto,
- ΔtF es la depresión del punto de congelación,
- TF (solvente) es el punto de congelación del solvente puro
- TF (solución) es el punto de congelación de la solución (soluciones de solvente +)
- KF ¿Es la depresión del punto de congelación?
- m es la molalidad de la solución.
Sin embargo, el soluto agregado debe ser un soluto no volátil, si no el soluto no afecta el punto de congelación del solvente porque se volatiliza fácilmente. No solo para soluciones, sino que este concepto también se puede utilizar para explicar los cambios en el punto de congelación de las mezclas sólidas. El compuesto sólido finamente en polvo tiene un punto de congelación más bajo que el compuesto sólido puro cuando están presentes las impurezas (mezcla sólida-sólida).
El punto de congelación es la temperatura a la que la presión de vapor de un disolvente y la presión de vapor la forma sólida de ese solvente es igual. Si se agrega un soluto no volátil a este disolvente, la presión de vapor del solvente puro disminuye. Entonces la forma sólida del solvente puede permanecer en equilibrio con el solvente incluso a temperaturas más bajas que el punto de congelación normal.
¿Qué es la elevación del punto de ebullición??
La elevación del punto de ebullición es el aumento del punto de ebullición de un solvente debido a la adición de un soluto al solvente. Aquí, el punto de ebullición de la solución (después de la adición de solutos) es más alto que el del solvente puro. Por lo tanto, la temperatura a la que la solución comienza a hervir es más alta que la de la temperatura habitual.

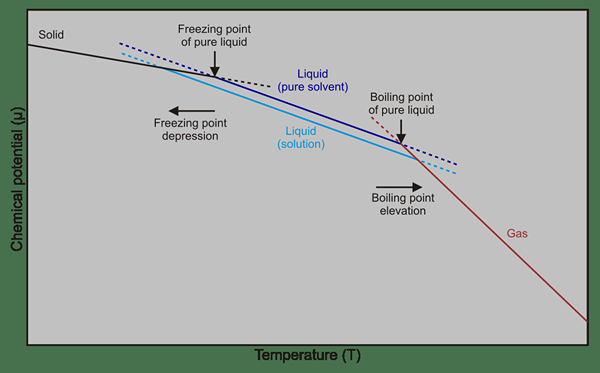
Figura 01: Punto de congelación y diferencias de punto de ebullición entre solvente puro y soluciones (solvente + solutos)
Sin embargo, el soluto agregado debe ser un soluto no volátil, o de lo contrario, el soluto volatilizará en lugar de disolverse en el solvente. La elevación del punto de ebullición también es una propiedad de coligeración, por lo que solo depende de la cantidad de solutos (no de la naturaleza del soluto).
Δtb = TB (solvente) - TB (solución)
O
Δtb = Kbmetro
En esto,
- Δtb es la elevación del punto de ebullición
- TB (solvente) es el punto de ebullición del solvente puro
- TB (solución) es el punto de ebullición de la solución (solvente + solutos)
- Kb es la constante de elevación del punto de ebullición
- m es la molalidad de la solución
Un ejemplo común de este fenómeno es el punto de ebullición de una solución salina acuosa. Una solución salina hierve a temperaturas más altas que 100 ° C (punto de ebullición del agua pura).
¿Cuál es la diferencia entre la depresión del punto de congelación y la elevación del punto de ebullición??
Punto de congelación Vs Elevación del punto de ebullición | |
| La depresión del punto de congelación es la disminución del punto de congelación de un solvente debido a la adición de un soluto al solvente. | La elevación del punto de ebullición es el aumento del punto de ebullición de un solvente debido a la adición de un soluto al solvente. |
| Temperatura | |
| La depresión del punto de congelación disminuye el punto de congelación de una solución. | La elevación del punto de ebullición aumenta el punto de ebullición de una solución. |
| Principio | |
| La depresión del punto de congelación hace que una solución se congele a una temperatura más baja que el solvente puro. | La elevación del punto de ebullición hace que una solución hervir a una temperatura más alta que el solvente puro. |
| Ecuación | |
| La depresión del punto de congelación viene dada por ΔTF = TF (solvente) - TF (solución) o ΔtF = KFmetro. | Elevación del punto de ebullición ΔTb = TB (solvente) - TB (solución) o Δtb = Kbmetro. |
Resumen -congelamiento Depresión de punto frente a la elevación del punto de ebullición
La depresión del punto de congelación y la elevación del punto de ebullición son dos principales propiedades de coligeración de la materia. La diferencia entre la depresión del punto de congelación y la elevación del punto de ebullición es que la depresión del punto de congelación disminuye el punto de congelación de una solución, mientras que la elevación del punto de ebullición aumenta el punto de ebullición de una solución.
Referencia:
1.Helmenstine, Anne Marie. "Qué es la elevación del punto de ebullición y cómo funciona."THEWLECO. Disponible aquí
2.“Elevación de punto de ebullición."Wikipedia, Fundación Wikimedia, 13 mar. 2018. Disponible aquí
3."Depresión del punto de congelación."Bibliotecas de química, Librettexts, 19 de febrero. 2018. Disponible aquí
Imagen de cortesía:
1.'Depresión del punto de congelación y elevación del punto de ebullición' por el trabajo de Tomás de Tomás (CC By-SA 3.0) a través de Commons Wikimedia


