Diferencia entre células galvánicas y células de concentración
El diferencia clave entre la célula galvánica y la célula de concentración es que un La célula galvánica puede o no tener las dos medias células con la misma composición, mientras que una célula de concentración tiene dos medias células con la misma composición.
Tanto la célula galvánica como la célula de concentración son células electroquímicas. Una célula electroquímica es un dispositivo que puede generar electricidad utilizando una reacción química o hacer que se produzca una reacción química usando electricidad.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la célula galvánica?
3. ¿Qué es la célula de concentración?
4. Comparación de lado a lado: célula de células galvánicas frente a célula de concentración en forma tabular
5. Resumen
¿Qué es una célula galvánica??
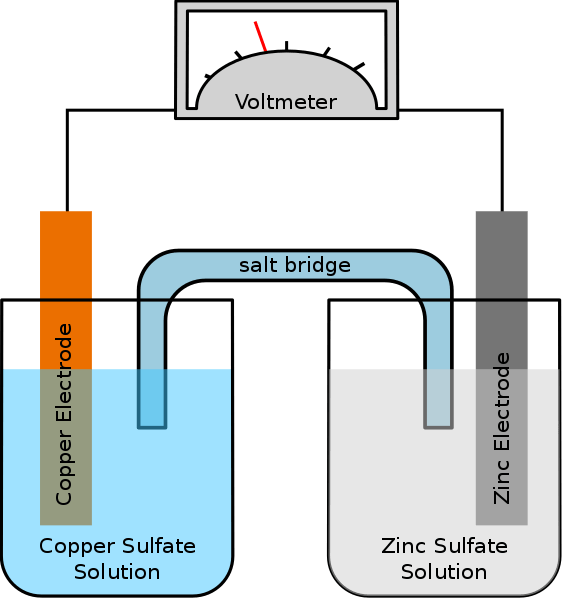
Una célula galvánica es un tipo de célula electroquímica que utiliza reacciones redox espontáneas para generar energía eléctrica. Un sinónimo de esta celda es la celda voltaica. La célula contiene dos medias células que pueden ser de la misma composición o de diferentes composiciones. Cada media celda contiene un electrodo y un electrolito. El electrodo debe sumergirse en la solución electrolítica. A veces, estos electrolitos están completamente separados, pero otras veces están separados solo por una barrera porosa. Cuando los electrolitos están completamente separados, necesitamos usar un puente de sal para mantener el movimiento de iones entre los dos electrolitos.

Figura 01: Célula galvánica simple
Al preparar esta celda, debemos considerar si los electrodos y los electrolitos son espontáneos o no. Podemos encontrarlo teóricamente calculando los potenciales de electrodo de cada media celda. Sin embargo, la célula media debería mostrar oxidación, mientras que la otra mitad célula debería mostrar una reacción de reducción. La oxidación ocurre en el ánodo, mientras que la reducción ocurre en el cátodo. Dado que una célula galvánica (voltaica) usa la energía liberada durante una reacción redox espontánea para generar electricidad, las células galvánicas son importantes como fuente de energía eléctrica. Producen corriente continua.
¿Qué es una célula de concentración??
La célula de concentración es un tipo de célula galvánica en la que las dos medias células de la célula son similares en composición. Por lo tanto, decimos que las dos medias células son equivalentes. Solo difieren en concentración. El voltaje producido por esta celda es muy pequeño ya que esta celda tiende a obtener un estado de equilibrio. El equilibrio se produce cuando las concentraciones de las dos medias células se vuelven iguales.
La célula de concentración produce electricidad mediante la reducción de la energía libre termodinámica del sistema. Dado que la composición de las medias células es similar, ocurre la misma reacción, pero en direcciones opuestas. Este proceso aumenta la concentración de la célula de concentración más baja y disminuye la concentración de la célula de mayor concentración. A medida que fluye la electricidad, se genera energía térmica. La célula absorbe esta energía como calor. Hay dos tipos de células de concentración de la siguiente manera:
- Célula de concentración de electrolitos: los electrodos están formados por la misma sustancia, y las medias células contienen el mismo electrolito con diferentes concentraciones
- Célula de concentración de electrodos: dos electrodos (de la misma sustancia) de diferentes concentraciones se sumergen en el mismo electrolito
¿Cuál es la diferencia entre la célula galvánica y la célula de concentración??
Una célula galvánica es un tipo de célula electroquímica que utiliza reacciones redox espontáneas para generar energía eléctrica. Una célula de concentración, por otro lado, es un tipo de célula galvánica en la que las dos medias células de la célula son similares en composición. Por lo tanto, la diferencia clave entre la célula galvánica y la célula de concentración es que las células galvánicas pueden o no tener las dos medias células con la misma composición, mientras que la célula de concentración tiene dos medias células con la misma composición.
Además, los electrodos de la célula galvánica se pueden hacer de la misma sustancia o diferentes sustancias, mientras que los electrodos de célula de concentración están hechos de la misma sustancia con la misma concentración o diferentes concentraciones. Además de estos, las células galvánicas tienen el mismo electrolito o electrolitos diferentes en dos medias células, mientras que las células de concentración tienen el mismo electrolito con la misma concentración o diferentes concentraciones.
La siguiente infografía resume la diferencia entre las células galvánicas y las células de concentración.

Resumen -Célula de células galvánicas vs concentración
Una célula galvánica es un tipo de célula electroquímica que utiliza reacciones redox espontáneas para generar energía eléctrica. La célula de concentración es un tipo de célula galvánica en la que las dos medias células de la célula son similares en composición. Por lo tanto, la diferencia clave entre la célula galvánica y la célula de concentración es que las células galvánicas pueden o no tener las dos medias células con la misma composición, mientras que la célula de concentración tiene dos medias células con la misma composición.
Referencia:
1. Helmenstine, Anne Marie. "Células electroquímicas."Thinkco, Jan. 26, 2019, disponible aquí.
Imagen de cortesía:
1. "Galvanic Cell" de Gringer - Archivo: Galvanische Zelle.PNG, de Tinux (CC BY-SA 3.0) a través de Commons Wikimedia


