Diferencia entre la electroforesis en gel y la página SDS

Diferencia de clave: electroforesis en gel vs SDS
La electroforesis en gel es una técnica que separa las macromoléculas en un campo eléctrico. Es un método común en biología molecular para separar el ADN, el ARN y las proteínas de las mezclas de acuerdo con sus tamaños moleculares. La página SDS es un tipo de electroforesis en gel que se utiliza para separar las proteínas de una mezcla de proteínas basada en sus tamaños. La electroforesis en gel es un término utilizado para referirse a la técnica normal aplicada para la separación de ADN, ARN y proteínas mientras La página SDS es un tipo de electroforesis en gel. Esta es la diferencia clave entre la electroforesis en gel y la página SDS.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la electroforesis en gel?
3. ¿Qué es la página SDS?
4. Comparación de lado a lado - Página de electroforesis de gel vs SDS
5. Resumen
¿Qué es la electroforesis en gel??
La electroforesis en gel es una técnica común utilizada en laboratorios para separar moléculas cargadas como ADN, ARN, proteínas, etc. de sus mezclas. Se utiliza un gel en la electroforesis en gel. Actúa como un tamiz molecular. Hay dos tipos de geles utilizados en la electroforesis en gel, a saber, agarosa y poliacrilamida. La selección de una preparación de gel y gel son factores importantes a considerar en electroforesis en gel, ya que el tamaño de poro del gel debe manipularse cuidadosamente para una buena separación de moléculas a través de la electroforesis en gel. La electroforesis en gel tiene un campo eléctrico conectado a dos extremos del gel. Un extremo del gel muestra una carga positiva, mientras que el otro extremo se carga negativamente.
El ADN y el ARN son moléculas cargadas negativamente. Una vez que se cargan en el gel desde el extremo negativo del gel y se aplican al campo eléctrico, migran a través de los poros de gel hacia el extremo cargado positivamente del gel. La velocidad de la migración depende de la carga y el tamaño de la molécula. Las moléculas más pequeñas migran fácilmente a través de los poros de gel que las moléculas más grandes. Por lo tanto, las moléculas más pequeñas viajan a una larga distancia a través del gel y las moléculas más grandes viajan a corta distancia. Para observar el viaje de las moléculas en el gel, se utilizan tipos especiales de colorantes. El campo eléctrico se aplica por un cierto período de tiempo y se detiene para evitar la pérdida de moléculas y mantener las moléculas en sus posiciones recorridas. Se pueden observar diferentes bandas en el gel. Estas bandas representan las moléculas de diferentes tamaños. Por lo tanto, la electroforesis en gel es útil para diferenciar las moléculas de acuerdo con sus tamaños.
La electroforesis en gel se incorpora a varias técnicas como una técnica preparatoria en biología molecular como PCR, RFLP, clonación, secuenciación de ADN, transferencia Southern, mapeo del genoma, etc.

Figura 01: electroforesis en gel de agarosa
¿Qué es la página SDS??
Electroforesis en gel de poliacrilamida de dodecil sulfato de sodio (Página SDS) es un tipo de electroforesis en gel utilizada para separar proteínas. Cuando la electroforesis en gel se usa para separar las proteínas, se necesitan tratamientos especiales ya que las proteínas no se cargan negativamente como el ADN y el ARN y no migran hacia el final positivo o el extremo negativo. Por lo tanto, las proteínas se desnaturalizan y se recubren con una carga negativa antes de la electroforesis en gel. Se realiza con un detergente llamado dodecil sulfato de sodio (SDS). La electroforesis en gel que utiliza SDS y un gel de poliacrilamida para el medio de apoyo se conoce como página SDS. Esta técnica se usa comúnmente en bioquímica, genética, forense y biología molecular.
Durante la página SDS, las proteínas se mezclan con SDS. SDS despliega las proteínas en forma lineal y las cubre con una carga negativa proporcional a su masa molecular. Debido a la carga negativa, las moléculas de proteínas migran hacia el extremo de carga positiva del gel y se separan de acuerdo con sus masas moleculares. En la página SDS, la poliacrilamida se usa como soporte sólido para el gel. La separación real de las proteínas depende principalmente de las propiedades del gel. Por lo tanto, la preparación del gel de poliacrilamida debe realizarse cuidadosamente y se deben usar concentraciones correctas de poliacrilamida. Los geles de poliacrilamida muestran una alta resolución que los geles de agarosa. Por lo tanto, la página SDS se considera una técnica de alta resolución para la separación de proteínas.
La página SDS es un tipo de electroforesis en gel desnaturalizante. Tiene una limitación importante en el análisis de proteínas. Dado que las proteínas SDS denaturan antes de la separación, no permite la detección de actividad enzimática, interacciones de unión a proteínas, cofactores de proteínas, etc.
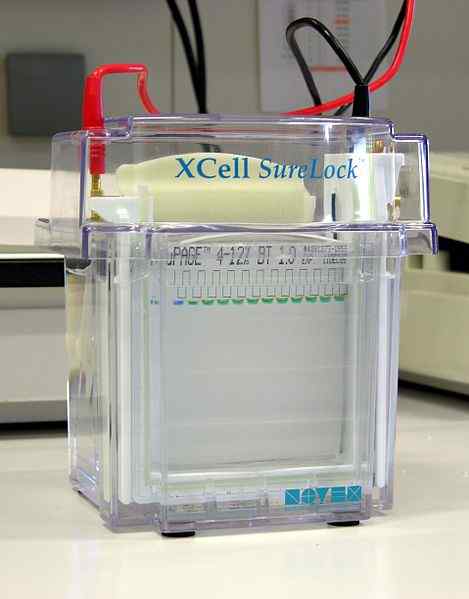
Figura 02: página SDS
¿Cuál es la diferencia entre la electroforesis en gel y la página de SDS??
Página de electroforesis de gel vs SDS | |
| La electroforesis en gel es un método realizado para separar las macromoléculas utilizando un campo eléctrico. | La página SDS es una técnica de electroforesis en gel de alta resolución utilizada para separar las proteínas basadas en su masa. |
| Gel Run | |
| Se puede realizar de manera horizontal o vertical. | La página SDS siempre se ejecuta verticalmente. |
| Base para la separación | |
| La separación ocurre de acuerdo con la carga y el tamaño. | La separación de proteínas ocurre de acuerdo con la masa y la carga. |
| Resolución | |
| La electroforesis en gel de agarosa tiene baja resolución y la electroforesis en gel de poliacrilamida tiene una mayor resolución | La página SDS tiene una mejor resolución. |
| Desnaturalización | |
| La electroforesis en gel incluye técnicas desnaturalizantes y no desnaturalizadas. | Proteínas de desnaturalización de la página SDS antes de la separación. |
Resumen -Página de electroforesis de gel vs SDS
La electroforesis en gel es una técnica común utilizada para la separación y el análisis de ADN, ARN y proteínas en función de su tamaño y carga. Hay dos tipos principales de electroforesis en gel, a saber, electroforesis en gel de agarosa y electroforesis en gel de poliacrilamida. Los geles de agarosa se usan principalmente para la separación del ácido nucleico; Cuando se requiere una mayor resolución, se usan geles de poliacrilamida. La página SDS es un tipo de electroforesis en gel comúnmente utilizada para separar mezclas complejas de proteínas. Se considera una técnica de separación de proteínas de alta resolución. Esta es la diferencia entre la electroforesis en gel y la página SDS.
Referencias:
1. Nowakowski, Andrew B., William J. Wobig y David H. Petición. "SDS-PAGE nativa: separación electroforética de alta resolución de proteínas con retención de propiedades nativas, incluidos los iones metálicos unidos. www.NCBI.NLM.NIH.gobierno. norte.pag., Mayo de 2014. Web. 7 abril. 2017
2. Stellwagen, Nancy C. “Electroforesis de ADN en geles de agarosa, geles de poliacrilamida y en solución libre."Electroforesis. U.S. Biblioteca Nacional de Medicina, junio de 2009. Web. 07 de abril. 2017
Imagen de cortesía:
1. "Gelelektrophoreseparatur" (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Electroforesis en gel de agarosa de ADN" por la Escuela de Recursos Naturales de Ann Arbor - ADN Lab (CC por 2.0) a través de Commons Wikimedia


