Diferencia entre el enlace glucosídico y el enlace péptido

Diferencia clave: enlace glucosídico vs enlace péptido
Los enlaces glucosídicos y los enlaces peptídicos son dos tipos de enlaces covalentes que se pueden encontrar en los sistemas vivos. La formación de ambos enlaces implica la eliminación de una molécula de agua y este proceso se llama reacciones de deshidratación (también conocidas como reacciones de condensación). Pero, estos dos enlaces son muy diferentes entre sí. El diferencia clave entre el enlace glucosídico y el enlace péptido está en la forma en que se forman; Los enlaces glucosídicos se encuentran en las moléculas de azúcar y los enlaces péptidos se forman entre dos aminoácidos.
¿Qué es el enlace glucosídico??
Un enlace glucosídico es un enlace covalente que une una molécula de carbohidratos (azúcar) con otro grupo; Puede ser otro grupo de carbohidratos o cualquier otro grupo. Este enlace se forma entre dos grupos funcionales; Un grupo hemiacetal o hemiketal de un asaccahárido o una molécula derivada de un sacárido con un grupo hidroxilo de otra molécula como una alcohol. El aglucósido es una sustancia que contiene un enlace glucosídico.
Los lazos glucosídicos juegan un papel muy especial en la existencia de organismos vivos en la tierra, ya que son importantes para la estructura de todas las sustancias.
¿Qué es el enlace péptido??
Un enlace peptídico también se conoce como enlace de amida que se forma entre dos moléculas de aminoácidos. Un aminoácido contiene dos grupos funcionales; un grupo de ácido carboxílico y un grupo amino. El enlace peptídico se forma entre un grupo amino de un aminoácido y un ácido carboxílico del otro aminoácido. Esta reacción elimina una molécula de agua (H2O) y, por lo tanto, se llama reacción de síntesis de deshidratación o una reacción de condensación. El vínculo resultante entre dos moléculas de aminoácidos se llama un enlace covalente. Estos enlaces se forman en los sistemas vivos y la formación de un enlace péptido consume energía que se deriva de ATP.
¿Cuál es la diferencia entre el enlace glucosídico y el enlace péptido??
Ocurrencia:
Bono glucosídico: Los enlaces glucosídicos se pueden encontrar en el azúcar que comemos, troncos de árboles, el exoesqueleto duro de las langostas y también en el ADN de nuestro cuerpo.
Enlace péptido: En general, los enlaces peptídicos se encuentran en proteínas y ácidos nucleicos, ADN y cabello.
Proceso:
Bono glucosídico: Un enlace glucosídico se forma mediante una reacción de condensación que implica la eliminación de una molécula de agua durante el proceso de formación. En contraste, la reacción inversa o la rotura de un enlace glucosídico es una reacción de hidrólisis; Una molécula de agua se usa en esta reacción.
La formación de un enlace glucosídico ocurre cuando un grupo de alcohol (-OH) de una molécula reacciona con el carbono anomérico de una molécula de azúcar. Un carbono anomérico es el átomo de carbono central de un hemiacetal que tiene enlaces individuales a dos átomos de oxígeno. Un átomo de oxígeno está unido al anillo de azúcar y el otro es del grupo -OH.
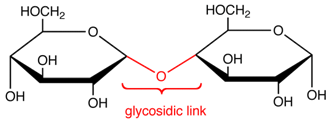
Figura 1: enlace glucosídico
Enlace péptido:
Se forma un enlace peptídico entre dos aminoácidos. Esto sucede cuando el grupo carboxílico de un aminoácido se reacciona con el grupo amino de otro aminoácido. Se elimina una molécula de agua durante este proceso para que se denomina reacción de deshidratación.
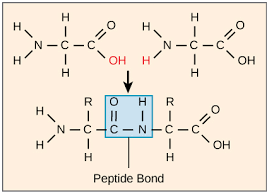
Figura 2: La formación de un enlace péptido entre dos aminoácidos
Definiciones:
ATP: Se considera que el trifosfato de adenosina (ATP) es la moneda energética de la vida. Es la molécula de alta energía que almacena la energía que necesitamos para hacer casi todo lo que hacemos.
Referencias: ScienceDailycom. (2016). Términos de referencia. Consultado el 12 de abril de 2016, desde aquí de la Universidad Estatal de Michigan - Departamento de Química, . (2016). Péptidos y proteínas. Consultado el 12 de abril de 2016, desde aquí Studycom. (2013). Bono glucosídico: definición y formación. Consultado el 12 de abril de 2016, desde aquí

