Diferencia entre la ley de derrame y difusión de Graham
El diferencia clave entre la ley de derrame y difusión de Graham es que La ley de derrame de Graham se aplica para un gas que pasa a través de una abertura que es más pequeña que las partículas de gas, mientras que la ley de difusión de Graham se aplica a las moléculas de gas que se dispersan por un contenedor.
La ley de Graham establece que la tasa de difusión o derrame de un gas es inversamente proporcional a la raíz cuadrada de su masa molar. Esta ley fue desarrollada por el químico físico Thomas Graham en 1848.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Cuál es la ley de derrame de Graham?
3. ¿Cuál es la ley de difusión de Graham?
5. Comparación de lado a lado: la ley de derrame y difusión de Graham en forma tabular
6. Resumen
¿Cuál es la ley de derrame de Graham??
La ley de derrame de Graham indica que la tasa de difusión o derrame de un gas es inversamente proporcional a la raíz cuadrada de su masa molar. Podemos dar esta ley como una expresión matemática de la siguiente manera;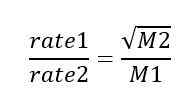
En esta expresión matemática, la velocidad1 es la tasa de derrame de un gas; La tasa2 es la tasa de derrame para un segundo gas; M1 es la masa molar del primer gas, mientras que M2 es la masa molar del segundo gas. Según esta relación, si la masa molar de un gas es cuatro veces la masa molar de otro gas, se difunde a través de un tapón poroso a la mitad de la velocidad del otro gas. La ley de Graham es la base para separar los isótopos por difusión (importante en la producción de la bomba atómica).
Para el derrame molecular de gases que implica el movimiento de un gas a la vez a través de un agujero, la ley de Graham es la teoría más precisa para el cálculo de la velocidad de la fuga de gases. Sin embargo, es solo aproximadamente preciso para la difusión de un gas en otro gas, ya que incluye el movimiento de un gas a otro gas.
¿Cuál es la ley de difusión de Graham??
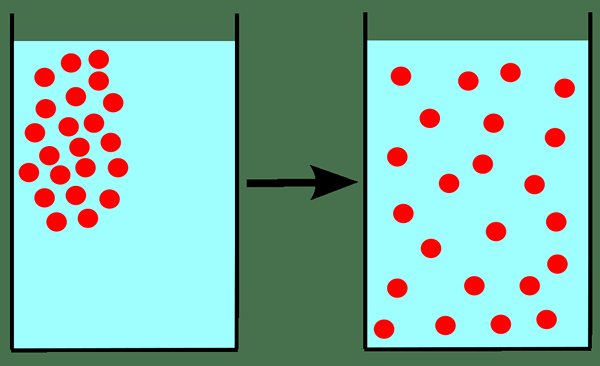
La ley de difusión de Graham es una ley en química que indica que la tasa de difusión o derrame de un gas es inversamente proporcional a la raíz cuadrada de su masa molar. Cuando aplicamos esta ley para la difusión de un gas, primero necesitamos saber qué es la difusión. La difusión se refiere a la mezcla gradual de gases debido al movimiento de partículas de gas en ausencia de agitación mecánica, como agitar.

Figura 01: difusión
Esta ley es solo aproximadamente precisa para la difusión de un gas en otro gas (porque incluye el movimiento de un gas en otro gas).
¿Cuál es la diferencia entre la ley de derrame y difusión de Graham??
La ley de Graham establece que la tasa de difusión o derrame de un gas es inversamente proporcional a la raíz cuadrada de su masa molar. La diferencia clave entre la ley de derrame y difusión de Graham es que la ley de derrame de Graham se aplica a un gas que pasa a través de una abertura que más pequeña que las partículas de gas, mientras que la ley de difusión de Graham se aplica para las moléculas de gas que se dispersan por un recipiente. Además, la ley de derrame de Graham es la ley más precisa para el derrame, mientras que la ley de difusión de Graham es solo aproximadamente precisa para la difusión.
A continuación, la infografía resume la diferencia entre la ley de derrame y difusión de Graham.

Resumen -La Ley de Decusión de Graham vs Difusión
La ley de Graham establece que la tasa de difusión o derrame de un gas es inversamente proporcional a la raíz cuadrada de su masa molar. La diferencia clave entre la ley de derrame y difusión de Graham es que la ley de derrame de Graham se aplica a un gas que pasa a través de una abertura que más pequeña que las partículas de gas, mientras que la ley de difusión de Graham se aplica para las moléculas de gas que se dispersan por un recipiente.
Referencia:
1. "2.9: Las leyes de difusión y derrame de Graham." Bibliotecas de química, Libretexts, 14 de julio de 2020, disponible aquí.
Imagen de cortesía:
1. "Difusión" de JRPol - Trabajo propio (CC por 3.0) a través de Commons Wikimedia


