Diferencia entre la masa atómica gram y la masa molecular de gramo
El diferencia clave entre la masa atómica gram y la masa molecular gram es que la La masa atómica de Gram da la masa de un átomo individual, mientras que la masa molecular de gramo da la masa de un grupo de átomos.
La masa atómica y la masa molecular (o masa molar) son muy importantes con respecto a los átomos y las moléculas. Cuando expresamos estos valores en unidades de gram, entonces es una masa atómica/molecular gram.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la masa atómica gram?
3. ¿Qué es la masa molecular gram?
4. Comparación de lado a lado: masa atómica gram vs gramo de masa molecular en forma tabular
5. Resumen
¿Qué es la masa atómica gram??
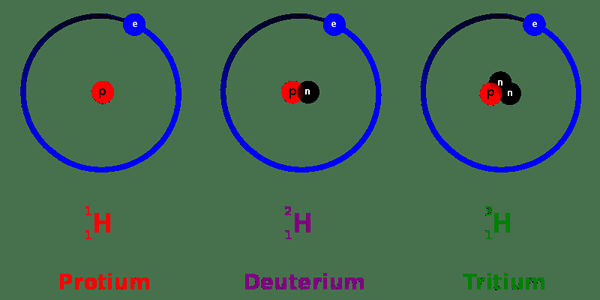
La masa atómica de Gram es la masa atómica expresada con la unidad "gramos". El valor de este parámetro es numéricamente igual a la masa atómica dada por la unidad "u". Este término está muy estrechamente relacionado con el número de masa. En realidad significa lo mismo literalmente; Sin embargo, en este caso, las formas isotópicas de cada elemento también se cuentan. Los elementos pueden existir en varias formas en la naturaleza. Estas diferentes formas se conocen generalmente como isótopos, y tienen la misma identidad que la forma más abundante/estable del elemento. Por lo tanto, los isótopos tienen el mismo número atómico, pero tienen diferentes números de masa. Se puede concluir que los isótopos llevan la misma cantidad de protones y electrones; es solo el número de neutrones que difieren. Por lo tanto, lo que difiere entre ellos es el peso.

Figura 01: Isótopos de hidrógeno
Al tener en cuenta cada forma isotópica, la masa de una forma elemental se puede expresar como un valor promedio, donde se promedian las masas individuales de cada forma isotópica. Además, esto se conoce como la 'masa atómica' de un elemento. Por lo tanto, la masa atómica tiene casi el mismo valor numérico que el número de masa, con solo un cambio de unos pocos valores decimales. Cada número se usa para su conveniencia dependiendo del contexto de uso.
¿Qué es la masa molecular gram??
La masa molecular gram de una molécula es la masa de un mol de esa molécula dada de la unidad "gramos". Eso significa; Es la suma de las masas de moléculas presentes en un lunar. Se calcula usando la fórmula molecular de una molécula. Aquí, se agregan los pesos atómicos de cada átomo en la unidad G/mol para obtener la masa molecular.
Un lunar de una molécula está compuesto por 6.023 x 1023 moléculas. Por lo tanto, la masa molecular es el peso de 6.023 x 1023 moléculas. Dado que se conocen las masas atómicas de cada elemento, es fácil calcular la masa molecular en lugar de pensar en un 6.023 x 1023 de moléculas.
¿Cuál es la diferencia entre la masa atómica gram y la masa molecular de gram?
La masa atómica gram y la masa molecular gram son las mismas que la masa atómica y la masa molecular, expresada en la unidad "gramos". Por lo tanto, la diferencia clave entre la masa atómica gram y la masa molecular de gram es que la masa atómica gram da la masa de un átomo individual, mientras que la masa molecular de gram da la masa de un grupo de átomos.
La siguiente infografía resume la diferencia entre la masa atómica gram y la masa molecular de gramo.
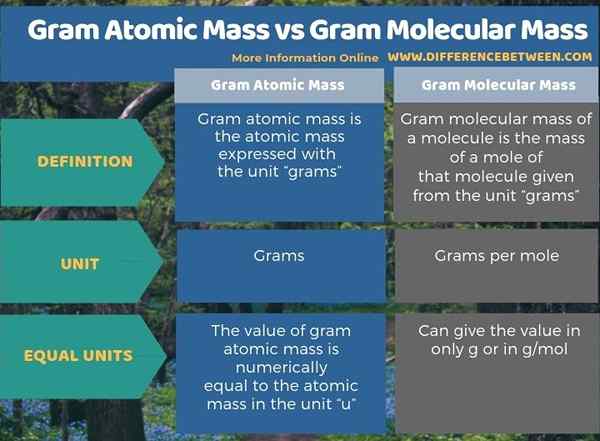
Resumen -Grama de masa atómica vs gramo de masa molecular
La masa atómica gram y la masa molecular gram son las mismas que la masa atómica y la masa molecular, expresada en la unidad "gramos". Por lo tanto, la diferencia clave entre la masa atómica gram y la masa molecular de gram es que la masa atómica gram da la masa de un átomo individual, mientras que la masa molecular de gram da la masa de un grupo de átomos.
Referencia:
1. Helmenstine, Anne Marie. “Definición de masa molecular de gramo."Thinkco, Jul. 3, 2019, disponible aquí.
Imagen de cortesía:
1. "Hidrógeno Deuterium Tritium Nuclei Schmatic -en" por Dirk Hünniger; Trabajo derivado en inglés - BalajiJagadesh - Este archivo se derivó de: Hydrogen Deuterium Tritium Nuclei Schmatic -De.SVG (CC BY-SA 3.0) a través de Commons Wikimedia


