Diferencia entre los metales del Grupo 1 y los metales de transición
El diferencia clave entre los metales del grupo 1 y los metales de transición es que Los metales del grupo 1 forman compuestos incoloros, mientras que los metales de transición forman compuestos coloridos.
Los metales del grupo 1 también se conocen como metales alcalinos porque estos elementos pueden formar compuestos alcalinos. Sin embargo, el grupo 1 de la tabla periódica contiene hidrógeno, que no es metálico. Los metales de transición, por otro lado, son elementos de bloque D, pero no todos los elementos de bloque D son metales de transición. Los metales del grupo 1 y los metales de transición son similares en el hecho de que ambos tienen electrones no apareados.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los metales del Grupo 1?
3. ¿Qué son los metales de transición?
4. Comparación de lado a lado - Metales de grupo 1 vs metales de transición en forma tabular
5. Resumen
¿Qué son los metales del Grupo 1??
Los metales del Grupo 1 son elementos químicos que tienen un electrón no apareado en el orbital más externo. Estos metales se nombran como metales alcalinos porque forman compuestos químicos que son alcalinos cuando se disuelven en agua. Podemos observar estos elementos en la primera columna del bloque S de la tabla periódica. Los miembros de este grupo 1 son los siguientes:
- Litio (Li)
- Sodio (NA)
- Potasio (k)
- Rubidium (RH)
- Cesio (CS)
- Francium (FR)
Los metales del Grupo 1 son todos brillantes, altamente reactivos y muy suaves (podemos cortarlos fácilmente con un cuchillo simple). En general, los metales en este grupo muestran bajas densidades, bajos puntos de fusión, bajos puntos de ebullición y tienen estructuras de cristal cúbicos centrados en el cuerpo. Además, tienen colores de llama distintos, por lo que podemos distinguirlos fácilmente exponiendo una muestra a un quemador Bunsen.
Además, hay algunas variaciones periódicas entre los metales del Grupo 1. Por ejemplo, al bajar del grupo, aumenta el tamaño atómico de los elementos, el punto de fusión y el punto de ebullición disminuyen, la densidad aumenta, la energía de la primera ionización aumenta, la reactividad disminuye, etc.
¿Qué son los metales de transición??
Los metales de transición son elementos químicos que tienen átomos con electrones D no apareados. En estos elementos, al menos los cationes estables que forman deben tener electrones D no emparejados. Por lo tanto, la mayoría de los elementos del bloque D son metales de transición. No podemos considerar el escandio y el zinc como metales de transición porque no tienen electrones no emparejados ni siquiera en sus cationes estables. Estos átomos tienen electrones D, pero todos son electrones emparejados.

Además, los elementos de metal de transición pueden formar diferentes compuestos con una variedad de colores. Estos elementos obtienen esta capacidad debido al hecho de que estos elementos pueden tener diferentes estados de oxidación que son muy coloridos. Estos diferentes estados de oxidación del elemento químico pueden tener diferentes colores. Además, estos colores surgen debido a las transiciones electrónicas D-D. Además, debido a la presencia de estos electrones no apareados, estos metales son paramagnéticos o ferromagnéticos. Casi todos estos elementos pueden unirse con ligandos para formar complejos de coordinación.
¿Cuál es la diferencia entre los metales del Grupo 1 y los metales de transición??
Los metales del grupo 1 y los metales de transición son diferentes entre sí, principalmente en función del color de los compuestos químicos que forman. Eso es; La diferencia clave entre los metales del Grupo 1 y los metales de transición es que los metales del Grupo 1 forman compuestos incoloros, mientras que los metales de transición forman compuestos coloridos.
Además, los metales del Grupo 1 son elementos químicos que tienen un electrón no apartado en el orbital S más externo, mientras que los metales de transición son elementos químicos que tienen átomos con electrones D no apareados.
A continuación, la infografía tabula las diferencias entre los metales del Grupo 1 y los metales de transición con más detalle.
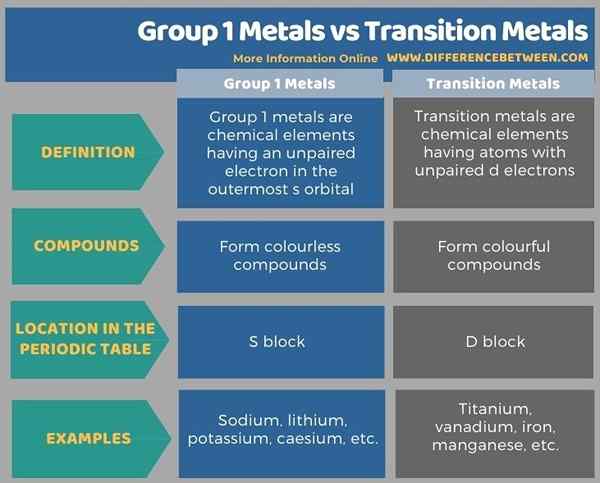
Resumen -Grupo 1 metales vs metales de transición
Los metales del grupo 1 y los metales de transición son diferentes entre sí, principalmente en función del color de los compuestos químicos que forman. La diferencia clave entre los metales del Grupo 1 y los metales de transición es que los metales del Grupo 1 forman compuestos incoloros, mientras que los metales de transición forman compuestos coloridos.
Referencia:
1. Algodón, F. Albert. "Metal de transición."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 abril. 2019, disponible aquí.
Imagen de cortesía:
1. "Gráfico periódico de mesa con no metales reactivos" por Sandbh - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia
2. Por Benjah-BMM27 asumido (basado en reclamos de derechos de autor). - Trabajo propio asumido (basado en reclamos de derechos de autor)., (Dominio público) a través de Commons Wikimedia


