Diferencia entre la mitad del punto de equivalencia y el punto de equivalencia
El diferencia clave Entre la mitad del punto de equivalencia y el punto de equivalencia es que La mitad del punto de equivalencia es el punto medio entre el punto de partida y el punto de equivalencia de una titulación particular, mientras que el punto de equivalencia es donde termina la reacción química.
Las titulaciones son técnicas analíticas en química que son importantes para determinar las concentraciones desconocidas de muestras dadas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el punto de equivalencia?
3. ¿Qué es la mitad del punto de equivalencia?
4. Comparación de lado a lado: punto de mitad de equivalencia frente al punto de equivalencia en forma tabular
5. Resumen
¿Qué es la mitad del punto de equivalencia??
El punto de equivalencia medio de una titulación es la mitad del punto de equivalencia y el punto de partida (origen). La importancia de este punto es que en este punto, el pH de la solución analito es igual a la constante de disociación o PKA del ácido utilizado en la titulación. El punto de equivalencia medio ocurre en el volumen de la mitad del primer punto de equivalencia de la titulación. Si hay múltiples puntos de equivalencia en la titulación, hay varios puntos de equivalencia medio que son iguales al número de puntos de equivalencia. Por ejemplo, un punto de equivalencia de la segunda mitad se produce en el punto medio entre los puntos de equivalencia de primera y segunda.
¿Qué es el punto de equivalencia??
El punto de equivalencia en una titulación es el punto real donde termina la reacción química deseada en la mezcla de reacción. Por lo general, hacemos titulaciones para determinar la concentración de una sustancia en un líquido. Si conocemos la sustancia, se puede usar un tituler (una solución utilizada para determinar la concentración de un componente en una mezcla líquida) que tiene una concentración conocida para reaccionar con el analito. Aquí, llamamos al titizante como una solución estándar porque se conoce su molaridad exacta.

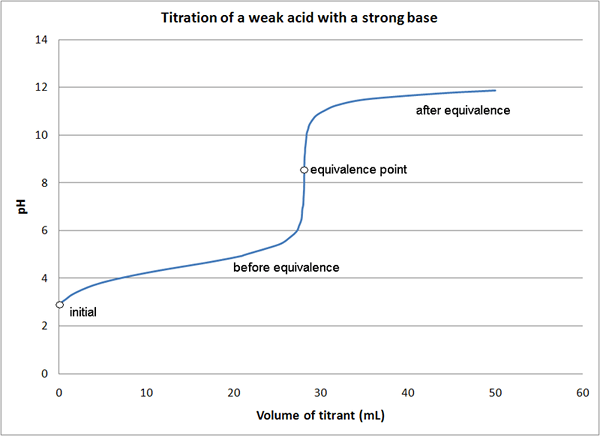
Figura 01: Curva de titulación que indica el punto de equivalencia
En la reacción entre NaOH y HCl, que es una reacción ácida-base, podemos usar NaOH o HCl como el titulador que tiene la concentración conocida. Aquí, el titulador se coloca en la bureta, y lentamente podemos agregarlo a la titula/analito hasta que ocurra un cambio de color en la mezcla de reacción. Necesitamos usar un indicador porque NaOH y HCL no son autoindicadores. El punto donde ocurre un cambio de color es el punto final de la titulación, que no es el punto de equivalencia de la reacción.
En esta titulación, el punto de equivalencia es el punto donde todas las moléculas de HCl han reaccionado con NaOH (o el punto donde todas las moléculas de NaOH han reaccionado con HCl). Entonces, los moles de titizante deben ser iguales a los moles del analito desconocido, ya que la estequiometría entre HCl y NaOH es 1: 1. Existen diferentes métodos para determinar el punto de equivalencia de una titulación.
- Cambio de color de autoindicadores - En las reacciones que involucran autoindicadores como reactivos, el cambio de color revela el punto de equivalencia de la titulación ya que no usan indicadores.
- Punto final- A veces, el punto de equivalencia se puede tomar como punto final, ya que son aproximadamente iguales.
- Conductancia- En este método, la conductancia se mide a lo largo de la titulación, y el punto de equivalencia es donde se produce un cambio rápido de conductancia. Este es un método algo difícil.
- Espectroscopia- Este es un método adecuado para mezclas de reacción coloridas. El punto de equivalencia se determina de acuerdo con el cambio rápido en las longitudes de onda que son absorbidas por la muestra.
¿Cuál es la diferencia entre la mitad del punto de equivalencia y el punto de equivalencia??
Las titulaciones son técnicas analíticas en química que son importantes para determinar las concentraciones desconocidas de muestras dadas. La diferencia clave entre la mitad del punto de equivalencia y el punto de equivalencia es que la mitad del punto de equivalencia es el punto medio entre el punto de partida y el punto de equivalencia de una titulación particular, mientras que el punto de equivalencia es donde termina la reacción química.
La tabulación a continuación resume la diferencia entre la mitad del punto de equivalencia y el punto de equivalencia.
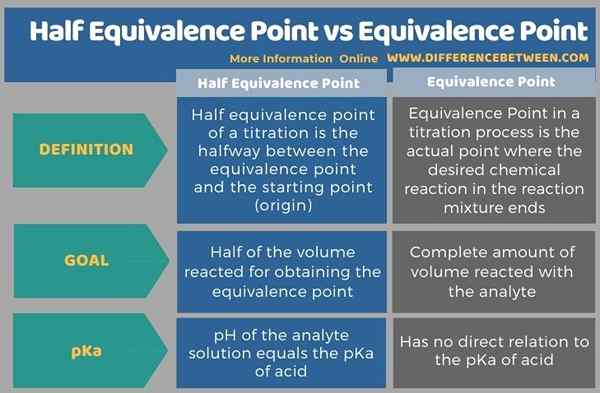
Resumen -punto de equivalencia medio versus punto de equivalencia
Las titulaciones son técnicas analíticas en química que son importantes para determinar las concentraciones desconocidas de muestras dadas. La diferencia clave entre la mitad del punto de equivalencia y el punto de equivalencia es que la mitad del punto de equivalencia es el punto medio entre el punto de partida y el punto de equivalencia de una titulación particular, mientras que el punto de equivalencia es donde termina la reacción química.
Referencia:
1. "Curvas de titulación y punto de equivalencia (artículo)." academia Khan, Disponible aquí.
Imagen de cortesía:
1. "Titulación de ácido débil con una base fuerte" por Quantumkinetics - Trabajo propio (CC por 3.0) a través de Commons Wikimedia


