Diferencia entre halógenos y haluros

El diferencia clave entre halógenos y haluros es que el Los halógenos son elementos químicos que tienen un electrón no apareado en su orbital más externo, mientras que los haluros no tienen electrones no apareados.
Los halógenos son los elementos del Grupo 7. Dado que tienen un electrón no apartado en los orbitales P, el estado de oxidación más común de los halógenos es -1 porque pueden ser estables al obtener un electrón. Este obteniendo un haluro de electrones. Por lo tanto, los haluros son la forma aniónica de halógenos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los halógenos?
3. Que son halidios
4. Comparación de lado a lado: halógenos vs haluros en forma tabular
5. Resumen
¿Qué son los halógenos??
Los halógenos son elementos químicos del Grupo 7 que tienen 5 electrones en el orbital más externo. Además, estos elementos tienen un electrón no apareado en su orbital más externo. Por lo tanto, es altamente reactivo obtener un electrón desde el exterior y volverse estable. Forman fácilmente la forma aniónica, haluro, obteniendo un electrón.

Figura 01: apariencia de halógenos. (De izquierda a derecha: cloro, bromo, yodo.)
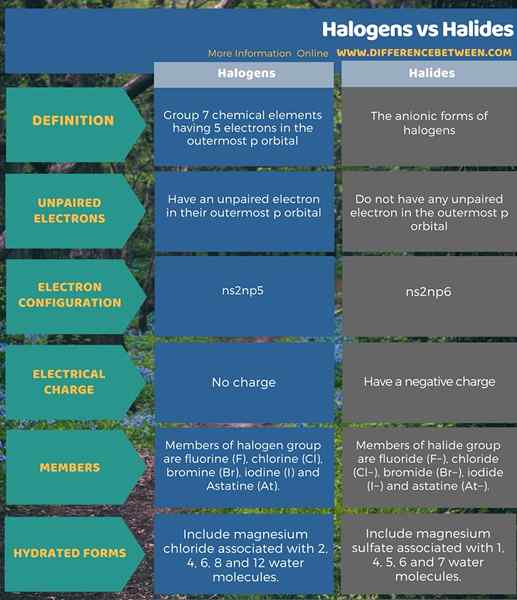
Los miembros de este grupo son flúor (f), cloro (CL), bromo (BR), yodo (i) y astatina (AT). Además, la razón para darles el nombre Halógeno es que todos pueden formar sales de sodio con propiedades similares. Podemos ver todas las fases de la materia dentro de este grupo; El fluorino y el cloro son gases de naturaleza, el bromo es un líquido y el yodo es un compuesto sólido en condiciones normales. Astatine es un elemento radiactivo. Además, la configuración general de electrones de estos elementos es NS2notario público5.
Que son halidios?
Los haluros son las formas aniónicas de halógenos. Por lo tanto, estas especies químicas se forman cuando un halógeno gana un electrón desde el exterior para obtener una configuración de electrones estable. Entonces la configuración de electrones se convierte en ns2notario público6. Sin embargo, un haluro siempre tendrá una carga negativa. Los miembros de este grupo incluyen fluoruro (F-), cloruro (cl-), bromuro (Br-), yoduro (yo-) y astatino (en-). Las sales que tienen estos iones son sales de haluro. Además, todos estos haluros son incoloros y ocurren en compuestos cristalinos sólidos. Estos sólidos tienen una alta entalpía negativa de formación. Por lo tanto, esto significa que estos sólidos se forman fácilmente.
Hay pruebas específicas de las cuales podemos identificar la presencia de un haluro. Por ejemplo, podemos usar nitrato de plata para indicar la presencia de cloruros, bromuros y yoduros. Esto se debe a que, cuando agregamos nitrato de plata a una solución que contiene iones de cloruro, precipitado por cloruro de plata. Si agregamos nitrato de plata a la solución que contiene bromuro, se forma un precipitado cremoso de bromuro de plata. Para las soluciones que contienen iones yoduro, ofrece un precipitado de color verde. Pero, no podemos identificar el fluoruro de esta prueba, ya que los fluoruros no pueden formar precipitados con nitrato de plata.
¿Cuál es la diferencia entre halógenos y haluros??
Los halógenos son los elementos químicos del Grupo 7 que tienen 5 electrones en el orbital P más externo, incluido un electrón no apareado. Los haluros son las formas aniónicas de halógenos y no tienen ningún electrón no apartado. Esta es la principal diferencia entre halógenos y haluros. Además, los miembros del grupo halógeno son flúor (F), cloro (CL), bromo (BR), yodo (I) y astatina (AT). Por otro lado, los miembros del grupo de haluro son fluoruro (F-), cloruro (cl-), bromuro (Br-), yoduro (yo-) y astatino (en-). A continuación se muestra la diferencia detallada entre halógenos y haluros en forma tabular.
Resumen -halógenos vs haluros
Los halógenos son elementos del Grupo 7 que tienen un electrón no apareado en el orbital externo. Se forman en halidios al ganar un electrón y volverse estables. Por lo tanto, la diferencia clave entre los halógenos y los haluros es que los halógenos son elementos químicos que tienen un electrón no apareado en su orbital más externo, mientras que los haluros no tienen electrones no apareados.
Referencia:
1. "Haluro."Wikipedia, Fundación Wikimedia, 27 de junio de 2018. Disponible aquí
2. Christe, Karl, et al. "Elemento halógeno."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 de noviembre. 2017. Disponible aquí
Imagen de cortesía:
1.'Halógenos' w. Oelen - Science Made Alive: Chemistry, (CC By -SA 3.0) a través de Commons Wikimedia


