Diferencia entre el calor de formación y el calor de reacción
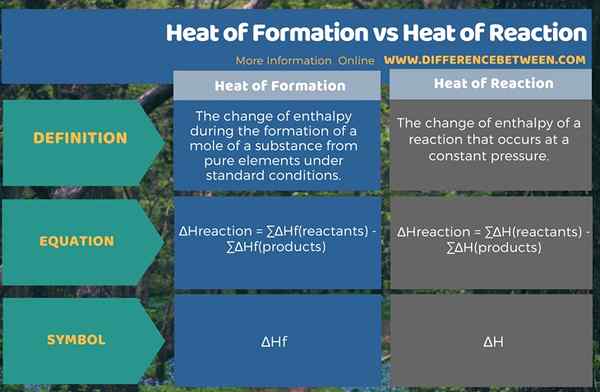
El diferencia clave entre el calor de formación y el calor de la reacción es que el El calor de formación es el cambio en la entalpía durante la formación de un lunar de una sustancia en condiciones estándar, mientras que el calor de reacción es el cambio de entalpía durante una reacción química que ocurre a una presión constante.
El calor de formación y el calor de reacción son valores importantes de entalpía con respecto a las reacciones químicas. Definimos estos términos para condiciones estándar, yo.mi. presión estándar y temperatura estándar. Aquí, el calor o la entalpía es la energía que se libera de un sistema o absorbida por un sistema durante la reacción química.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el calor de la formación?
3. ¿Qué es el calor de la reacción?
4. Comparación de lado a lado: calor de formación frente al calor de reacción en forma tabular
5. Resumen
¿Qué es el calor de la formación??
El calor de la formación es el cambio de entalpía durante la formación de un lunar de una sustancia de elementos puros en condiciones estándar. Aquí, las condiciones estándar son de 1 caj de cajero y 298.15 Kelvin Temperatura. Dado que consideramos la formación de un mole, la unidad para esta energía es KJ/Mol. Esta energía es la energía que libera la reacción de formación o la energía que consume la reacción durante la progresión. La ecuación para esta entalpía es la siguiente;

Aquí, ∆ es un símbolo, que indica un cambio en la entalpía, h es la cantidad de energía y F indica una reacción de formación. En esta reacción, todos los componentes están en condiciones estándar, de lo contrario, no es el calor de la formación. Por ejemplo, la formación de dióxido de carbono es la siguiente.
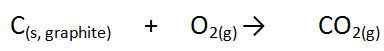
La forma elemental pura de carbono es el grafito y la fuente de oxígeno es la molécula de oxígeno diatómico. Cuando hacemos esta reacción de formación en condiciones estándar y medimos el cambio en la entalpía, lo llamamos el calor de la formación.
¿Qué es el calor de la reacción??
El calor de reacción es el cambio de entalpía de una reacción que ocurre a una presión constante. Medimos esta diferencia de energía en la unidad de KJ/Mol. Da la energía que se libera o absorbe durante una reacción química. El símbolo de este cambio de entalpía es ∆H. Si el valor es un valor positivo, lo llamamos una reacción endotérmica. Si el valor es negativo, lo llamamos una reacción exotérmica. La ecuación para este cambio de entalpía es la siguiente;
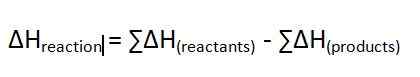
¿Cuál es la diferencia entre el calor de formación y el calor de reacción??
El calor de la formación es el cambio de entalpía durante la formación de un lunar de una sustancia de elementos puros en condiciones estándar. El símbolo de este cambio de entalpía es, ∆HF. El calor de reacción es el cambio de entalpía de una reacción que ocurre a una presión constante. El símbolo de este cambio de entalpía es, ∆H.

Resumen: calor de formación vs calor de reacción
La entalpía es el contenido de energía. El cambio de entalpía indica cuántos intercambios de energía entre reactivos, productos y los alrededores. La diferencia entre el calor de formación y el calor de reacción es que el calor de la formación es el cambio de entalpía durante la formación de un mol de una sustancia en condiciones estándar, mientras que el calor de reacción es el cambio de entalpía durante una reacción química que ocurre en una presión constante.
Referencia:
1. Bibliotecas. "Entalpía estándar de la formación."Bibliotecas de química, Librettexts, 9 de febrero. 2017. Disponible aquí
2. Britannica, los editores de Encyclopedia. "Calor de reacción."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 4 abril. 2016. Disponible aquí


