Diferencia entre holoenzima y apoenzima

Diferencia clave: holoenzima vs apoenzima
Las enzimas son catalizadores biológicos que aumentan la tasa de reacciones químicas en el cuerpo. Son proteínas formadas por secuencias de aminoácidos. Las enzimas están involucradas en las reacciones químicas sin ser consumidas. Son específicos para sustratos y reacciones químicas. La función de la enzima está respaldada por diferentes moléculas pequeñas no protegidas. Se conocen como cofactores. Ayudan a las enzimas en su acción catalítica. Estos cofactores pueden ser iones metálicos o coenzimas; También pueden ser moléculas inorgánicas u orgánicas. Muchas enzimas requieren que un cofactor se activa e inicie la función catalítica. Según la unión con el cofactor, las enzimas tienen dos formas llamadas apoenzima y holoenzima. La diferencia clave entre la holoenzima y la apoenzima es que Apoenzyme es el componente proteico de la enzima que está inactiva y no está unida al cofactor mientras La holoenzima es el componente proteico de la enzima y el cofactor unido que crea la forma activa de la enzima.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la holoenzima?
3. ¿Qué es la apoenzima?
4. Comparación de lado a lado: holoenzima vs apoenzima en forma tabular
5. Resumen
¿Qué es la holoenzima??
Las enzimas son proteínas que catalizan las reacciones bioquímicas en las células. La mayoría de las enzimas requieren una pequeña molécula no proteína para iniciar funciones catalíticas. Estas moléculas se conocen como cofactores. Los cofactores son principalmente moléculas inorgánicas u orgánicas. Los cofactores se clasifican en dos tipos principales llamados iones metálicos y coenzimas. La unión del cofactor es esencial para la activación de la enzima y el inicio de la reacción química. Cuando el componente proteico de la enzima se une al cofactor, la molécula completa se conoce como holoenzima. La holoenzima es catalíticamente activa. Por lo tanto, se une activamente con los sustratos y aumenta la velocidad de la reacción. Las coenzimas se unen libremente con las enzimas, mientras que los grupos protésicos se unen firmemente con las apoenzimas. Algunos cofactores se unen al sitio activo de la enzima. Tras la unión, cambia la conformación de la enzima y mejora la unión de sustratos al sitio activo de la enzima.
La ADN polimerasa y la ARN polimerasa son dos holoenzimas. La ADN polimerasa requiere iones de magnesio para actuar e iniciar la polimerización de ADN. La ARN polimerasa necesita factor sigma para su función catalítica.
¿Qué es la apoenzima??
La agoenzima es la enzima antes de unirse con el cofactor. En otras palabras, la apoenzima es la parte proteica de la enzima que carece del cofactor. Apoenzyme es catalíticamente inactiva e incompleta. Forma un sistema enzimático activo al combinar con una coenzima y determina la especificidad de este sistema para un sustrato. Hay muchos cofactores que se unen con apoenzimas para hacer holoenzimas. Las coenzimas comunes son NAD+, FAD, coenzima A, B vitaminas y vitamina C. Los iones metálicos comunes que se unen con apoenzimas son hierro, cobre, calcio, zinc, magnesio, etc. Los cofactores se unen bien o libremente con la apoenzima para convertir la apoenzima en holoenzima. Una vez que el cofactor se retira de la holoenzima, se convierte nuevamente en apoenzima, que está inactiva e incompleta.
La presencia del cofactor en el sitio activo de la apoenzima es esencial porque proporcionan grupos o sitios que la parte proteica de la enzima no posee para catalizar la reacción.
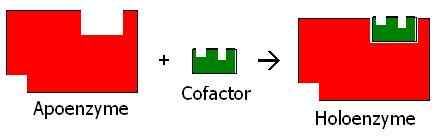
Figura 01: apoenzima y holoenzima
¿Cuál es la diferencia entre holoenzima y apoenzima??
Holoenzima vs apoenzima | |
| La holoenzima es una enzima activa que consiste en una apoenzima unida a su cofactor. | Apoenzyme es el componente proteico que carece de su cofactor. |
| Cofactor | |
| La holoenzima está vinculada a su cofactor. | Apoenzyme es el componente enzimático sin el cofactor. |
| Actividad | |
| La holoenzima es catalíticamente activa. | La apoenzyme es catalíticamente inactiva. |
| Lo completo | |
| La holoenzima es completa y puede iniciar la reacción. | Apoenzyme está incompleta y no puede iniciar la reacción. |
| Ejemplos | |
| La ADN polimerasa, la ARN polimerasa son ejemplos de holoenzym. | El aspartato transcarbamoilasa es un ejemplo para la apoenzima. |
Resumen -holoenzima vs apoenzima
Las enzimas son catalizadores biológicos de las células. Bajan la energía necesaria para la ocurrencia de reacción. Las enzimas aumentan la tasa de reacción al inducir activamente la conversión del sustrato a los productos. Catalizan específicamente las reacciones sin entrar en las reacciones. Las enzimas están compuestas de moléculas de proteínas. La porción de proteína de la enzima se conoce como apoenzima. La apoenzima necesita unirse con moléculas pequeñas no proteinaces llamadas cofactores para estar activos. Cuando la apoenzima se une con el cofactor, el complejo se conoce como holoenzima. La holoenzima es catalíticamente activa para iniciar la reacción química. El sustrato se une con la holoenzima, no con la apoenzima. Esta es la diferencia entre holoenzima y apoenzima.
Descargar versión PDF de holoenzima vs apoenzima
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según las notas de la cita. Descargue la versión PDF aquí Diferencia entre holoenzima y apoenzima.
Referencias:
1."Bioquímica estructural/enzima/apoenzima y holoenzima."Bioquímica estructural/enzima/apoenzima y holoenzima - Wikibooks. norte.pag., norte.d. Web. Disponible aquí. 12 de junio de 2017.
2. BIOQUÍMICA. norte.pag., norte.d. Web. Disponible aquí. 13 de junio de 2017.
Imagen de cortesía:
1. "Enzimas" de Moniquepena - Trabajo propio (dominio público) a través de Commons Wikimedia


