Diferencia entre homo y lumo
El diferencia clave Entre Homo y Lumo es que el Homo dona electrones, mientras que el LUMO recibe electrones.
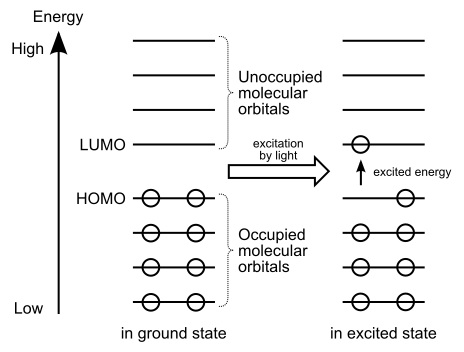
Los términos Homo y Lumo están bajo la "teoría orbital molecular" subtópica en química general. El término homo significa "orbital molecular más alto ocupado", mientras que el término LUMO representa el "orbital molecular desocupado más bajo". Los llamamos "orbitales fronterizos". Un orbital molecular proporciona la ubicación más probable de un electrón en un átomo. Forma de orbitales moleculares a partir de la combinación de orbitales atómicos de dos átomos separados para compartir sus electrones. Este intercambio de electrones forma un enlace covalente entre los átomos. Al formar estos orbitales moleculares, se dividen en dos formas como Homo y Lumo.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es homo
3. Que es LUMO
4. Comparación de lado a lado - Homo vs Lumo en forma tabular
5. Resumen
Que es homo?
HOMO significa orbital molecular mejor ocupado. Los electrones en estos orbitales moleculares se pueden donar a los orbitales moleculares de tipo LUMO. Esto se debe a que estos orbitales moleculares contienen electrones débilmente unidos. Estos orbitales moleculares son la forma más disponible para la unión química covalente. La presencia de estos orbitales moleculares es característica de las sustancias nucleofílicas.
El homo tiene baja energía. Por lo tanto, los electrones tienden a mantenerse en estos orbitales moleculares; porque los electrones intentan llenar primero los bajos niveles de energía. Es por eso que los llamamos "orbitales ocupados". Además, en presencia de la luz, las excitaciones de electrones pueden donar electrones de Homo a LUMO.
Que es LUMO?
Lumo significa orbital molecular desocupado más bajo. Estos orbitales moleculares pueden recibir electrones de Homo. Como su nombre lo indica, estos orbitales están desocupados; Por lo tanto, no contiene electrones. Esto se debe a que la energía de estos orbitales es muy alta y los electrones tienden a ocupar en niveles bajos de energía primero. Aparte de eso, estos orbitales moleculares son característicos para las sustancias electrofílicas.

Figura 01: La transferencia de electrones de Homo a Lumo
Además, si proporcionamos energía de la luz, los electrones del homo pueden excitarse y moverse a Lumo. Por eso decimos que Lumo puede recibir electrones.
¿Cuál es la diferencia entre Homo y Lumo??
HOMO significa orbital molecular más alto ocupado, mientras que el término LUMO significa orbital molecular desocupado más bajo desocupado. Ambas formas de orbitales son importantes en la unión química covalente, especialmente en la formación de enlaces PI. Como la diferencia clave entre Homo y Lumo, podemos decir que el Homo puede donar electrones, mientras que el LUMO puede recibir electrones. Además, la presencia de Homo es característica de los nucleófilos, mientras que la presencia de LUMO es característica para los electrofilos.
La siguiente infografía presenta más detalles sobre la diferencia entre Homo y Lumo.
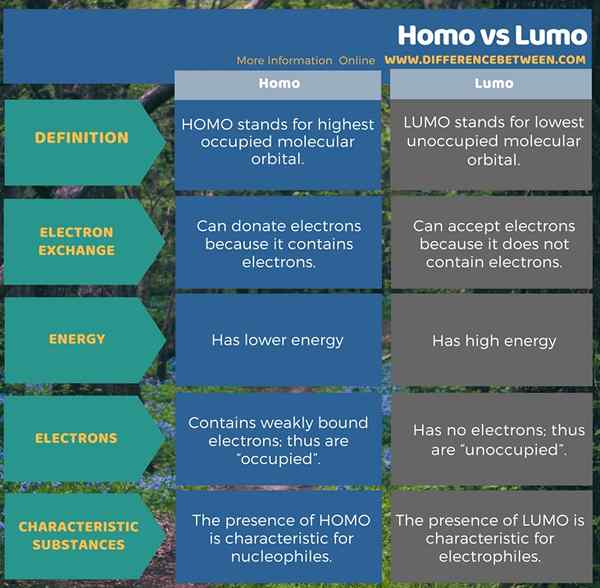
Resumen -Homo vs Lumo
La teoría del orbital molecular fronteriza explica la formación de orbitales moleculares de tipo homo y LUMO. Aunque hay varias diferencias entre estos dos tipos, la diferencia clave entre Homo y Lumo es que Homo dona electrones, mientras que LUMO recibe electrones.
Referencia:
1. Hunt, Ian R. "CH 10: Introducción a la teoría de MO."CH 13 - NMR Conceptos básicos. Disponible aquí
2. "Introducción a la teoría orbital molecular."Indicadores ácidos_base, Henry Rzepa. Disponible aquí
Imagen de cortesía:
1."Diagrama Molecule Homo-Lumo” de Tomgally (dominio público) a través de Commons Wikimedia


