Diferencia entre el equilibrio homogéneo y heterogéneo
El diferencia clave entre el equilibrio homogéneo y heterogéneo es que En el equilibrio homogéneo, los reactivos y los productos están en la misma fase de la materia, mientras que, en el equilibrio heterogéneo, los reactivos y los productos están en diferentes fases.
El equilibrio es un estado en el que las concentraciones de reactivos y productos permanecen constantes. Hay dos tipos de equilibrios como equilibrio homogéneo y equilibrio heterogéneo. Estos dos tipos difieren entre sí según la fase de la materia de los reactivos y productos en el equilibrio.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el equilibrio homogéneo?
3. ¿Qué es el equilibrio heterogéneo?
4. Comparación de lado a lado - homogéneo vs. Equilibrio heterogéneo en forma tabular
5. Resumen
¿Qué es el equilibrio homogéneo??
El equilibrio homogéneo es un estado en el que los reactivos y los productos están en la misma fase de la materia. Por lo general, los reactivos y los productos están en una sola solución. Llamamos a este tipo de mezcla de reacción como una mezcla homogénea. Las especies químicas que están en esta mezcla pueden ser moléculas, iones o una combinación de moléculas e iones. Además, la expresión para la constante de equilibrio de este tipo de reacción incluye concentraciones de todos los reactivos y productos. Por ejemplo, la mezcla de gas de dióxido de azufre y gas oxígeno proporciona gas trióxido de azufre, todos los reactivos y productos están en la fase gaseosa. Entonces la reacción y la constante de equilibrio (k) son las siguientes:
2SO2 (g) + O2 (g) ⇌ 2So3 (g)
K = [SO3 (g)]2/[ENTONCES2 (G)2[O2 (g)]

¿Qué es el equilibrio heterogéneo??
El equilibrio heterogéneo es un estado en el que los reactivos y los productos están en diferentes fases. Allí las fases pueden haber cualquier combinación de fases sólidas, líquidas y de gas. Sin embargo, a diferencia de los equilibrios homogéneos, al escribir la constante de equilibrio para el equilibrio heterogéneo, tenemos que excluir las concentraciones de sólidos y líquidos puros. Por ejemplo, la mezcla de carbono en forma sólida con gas oxígeno da gas monóxido de carbono. Entonces la reacción y la constante de equilibrio (k) son las siguientes:
O2(gramo) + 2C(s) ⇌ 2CO(gramo)
K = [CO(gramo)]2/[O2 (g)]
¿Cuál es la diferencia entre el equilibrio homogéneo y heterogéneo??
El equilibrio es un estado en el que las concentraciones de reactivos y productos permanecen constantes. Hay dos tipos de equilibrios como equilibrio homogéneo y equilibrio heterogéneo. La diferencia clave entre el equilibrio homogéneo y heterogéneo es que en el equilibrio homogéneo, los reactivos y los productos están en la misma fase de la materia, mientras que, en el equilibrio heterogéneo, los reactivos y los productos están en diferentes fases.
Además, al determinar la constante de equilibrio para los equilibrios homogéneos, tenemos que incluir concentraciones de todos los reactivos y productos; Sin embargo, al determinar los equilibrios heterogéneos, tenemos que excluir las concentraciones de sólidos y líquidos puros y necesitamos usar las concentraciones de otros reactivos y productos. Como ejemplo, 2SO2 (g) + O2 (g) ⇌ 2So3 (g) es un equilibrio homogéneo y o2 (g) + 2C(s) ⇌ 2CO(gramo) es un ejemplo para un equilibrio heterogéneo.
A continuación, la infografía tabula la diferencia entre el equilibrio homogéneo y heterogéneo.
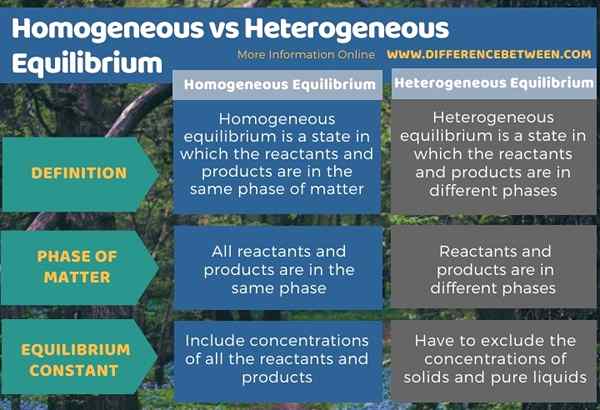
Resumen -homogéneo vs. Equilibrio heterogéneo
El equilibrio es un estado en el que las concentraciones de reactivos y productos permanecen constantes. Hay dos tipos de equilibrios como equilibrio homogéneo y equilibrio heterogéneo. La diferencia clave entre el equilibrio homogéneo y heterogéneo es que en el equilibrio homogéneo, los reactivos y los productos están en la misma fase de la materia, mientras que, en el equilibrio heterogéneo, los reactivos y los productos están en diferentes fases. Además, la constante de equilibrio para los equilibrios homogéneos incluye concentraciones de todos los reactivos y productos, mientras que la constante de equilibrio para los equilibrios heterogéneos tiene que excluir las concentraciones de sólidos y líquidos puros.
Referencia:
1."¿Qué son las reacciones de equilibrio homogéneas y heterogéneas". Estudiar.com, estudio.com, disponible aquí.
2."15.4: Equilibrios heterogéneos."Bibliotecas de química, Librettexts, 18 de septiembre. 2019, disponible aquí.
3. "Equilibrio de solución homogénea versus heterogénea."Biología ilimitada. Lumen, disponible aquí.
Imagen de cortesía:
1. "Mezclas y sustancias puras 2 × 2" de John Trombley - Trabajo propio (CC por 4.0) a través de Commons Wikimedia


