Diferencia entre los complejos homolépticos y heterolépticos
El diferencia clave entre los complejos homolépticos y heterolépticos es que Los complejos homolépticos tienen ligandos idénticos unidos a un centro de metal, mientras que los complejos heterolépticos tienen al menos un ligando diferente unido al centro de metal del complejo.
Los términos complejos homolépticos y heterolépticos se encuentran bajo química inorgánica, donde discutimos los complejos de metales de transición. Estos dos tipos de complejos difieren entre sí de acuerdo con la naturaleza de los ligandos unidos al centro de metal.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los complejos homolépticos?
3. ¿Qué son los complejos heterolépticos?
4. Comparación de lado a lado: complejos heterolépticos homolépticos vs en forma tabular
5. Resumen
¿Qué son los complejos homolépticos??
Los complejos homolépticos son compuestos químicos que contienen ligandos idénticos unidos a un centro de metal. Encontramos este término en química inorgánica cuando discutimos los complejos de metales de transición. El prefijo "homo-" se refiere a "lo mismo para todos".

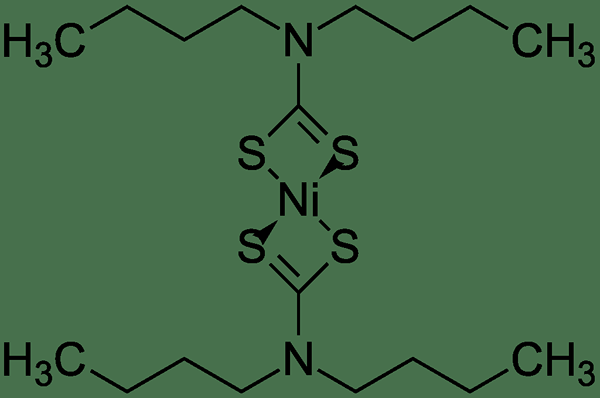
Figura 01: Un complejo homoléptico con dos ligandos similares unidos al mismo centro de metal
Un ejemplo común para dicho complejo es el complejo de magnesio de dialquilo que existe en una solución del reactivo Grignard en un éter, con dos ligandos de éter unidos a cada centro de magnesio. Otro ejemplo de un complejo homoléptico es el trimetilaluminio en un éter como el THF. Este complejo contiene tres grupos metilo unidos a un ion metálico de aluminio central con +3 carga positiva. Del mismo modo, el triaril o el borano de ensayo son complejos homolépticos.
¿Qué son los complejos heterolépticos??
Los complejos heterolépticos son compuestos químicos que contienen al menos un ligando diferente unido al centro de metal. Algunos ligandos que están involucrados en formaciones de complejos de metales de transición, como DMSO, pueden unirse con dos o más modos de coordinación diferentes. En tal caso, consideramos que el complejo metálico es homoléptico, con solo un tipo de ligandos con diferentes modos de coordinación.
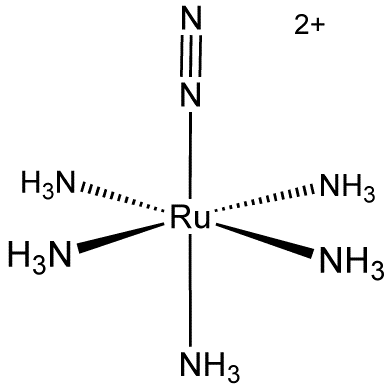
Figura 02: Un complejo heteroléptico que tiene cinco ligandos similares y un ligando diferente
Un ejemplo común de un complejo heteroléptico es el complejo de cobalto (III), con cuatro ligandos de amoníaco y dos ligandos de cloruro. El término complejo polinuclear, por otro lado, es diferente del término complejo heteroléptico porque los complejos polinucleares son complejos de metales de transición que tienen dos o más centros de metal con ligandos unidos. Sin embargo, también es un tipo de complejo heteroléptico si los ligandos unidos a los centros de metal son diferentes entre sí.
¿Cuál es la diferencia entre los complejos homolépticos y heterolépticos??
Los términos complejos homolépticos y heterolépticos están bajo la química inorgánica donde discutimos los complejos de metales de transición. Estos dos tipos de complejos difieren entre sí de acuerdo con la naturaleza de los ligandos unidos al centro de metal. La diferencia clave entre los complejos homolépticos y heterolépticos es que los complejos homolépticos tienen ligandos idénticos unidos a un centro de metal, mientras que los complejos heterolépticos tienen al menos un ligando diferente unido al centro de metal del complejo. Además, los complejos homolépticos son menos complejos que los complejos heterolépticos.
A continuación se muestra una tabulación resumida de la diferencia entre los complejos homolépticos y heterolépticos.

Resumen -complejos heteterolépticos homolépticos vs
Los términos complejos homolépticos y heterolépticos están bajo la química inorgánica donde discutimos los complejos de metales de transición. Estos dos tipos de complejos difieren entre sí de acuerdo con la naturaleza de los ligandos unidos al centro de metal. La diferencia clave entre los complejos homolépticos y heterolépticos es que los complejos homolépticos tienen ligandos idénticos unidos a un centro de metal, mientras que los complejos heterolépticos tienen al menos un ligando diferente unido al centro de metal del complejo.
Referencia:
1. "Complejos heterolépticos."Coordinación Química de ácidos hidroxámicos, 14 de diciembre. 2014, disponible aquí.
2. "Homoléptico."Wikipedia, Fundación Wikimedia, 7 de junio de 2020, disponible aquí.
Imagen de cortesía:
1. "Nickel (ii) Dibutylcarbamodithioate 200" por Emeldir (charla) - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Rua5n2" de Smokefoot - Trabajo propio (dominio público) a través de Commons Wikimedia


