Diferencia entre la energía de disociación de enlaces homolíticos y heterolíticos
Diferencia clave - Energía de disociación de enlaces homolíticos vs heterolíticos
La energía de disociación del enlace es una medida de la resistencia de un enlace químico. Un enlace puede disociarse de manera homolítica o de manera heterolítica. La energía de disociación del enlace se define como el cambio de entalpía estándar cuando un enlace químico se escinde mediante homólisis. La energía de disociación del enlace homolítico es la cantidad de energía requerida para disociar un enlace químico a través de la hemólisis, mientras que la energía de disociación del enlace heterolítico es la cantidad de energía requerida para clavar un enlace químico a través de la heterólisis. El valor de la energía de disociación del enlace homolítico es diferente del de la energía de disociación del enlace heterolítico para el mismo compuesto. Esta es la diferencia clave entre la energía de disociación del enlace homolítico y heterolítico.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la energía de disociación del enlace homolítico?
3. ¿Qué es la energía de disociación del enlace heterolítico?
4. Comparación lado a lado: energía de disociación de enlaces homolítico vs heterolítico en forma tabular
5. Resumen
¿Qué es la energía de disociación del enlace homolítico??
El enlace homolítico La energía de disociación es la cantidad de energía requerida para disociar un enlace químico a través de la hemólisis. La hemólisis de un enlace químico es la escisión simétrica del enlace que forma dos radicales, no dos iones. Aquí, los electrones de enlace entre los átomos se dividen en dos mitades y son tomados por los dos átomos. Por ejemplo, la escisión homolítica de un enlace sigma forma dos radicales que tienen un electrón no apareado por cada radical.

Figura 1: Homólisis
La energía de disociación del enlace se define como la cantidad de energía requerida para escindir un enlace químico a través de la hemólisis en condiciones estándar. La energía de disociación del enlace homolítico determina si un enlace químico es fuerte o débil. Si el valor de la energía de disociación del enlace homolítico es mayor, indica que se debe proporcionar una alta cantidad de energía para escindir ese enlace; Por lo tanto, es un fuerte vínculo.
¿Qué es la energía de disociación del enlace heterolítico??
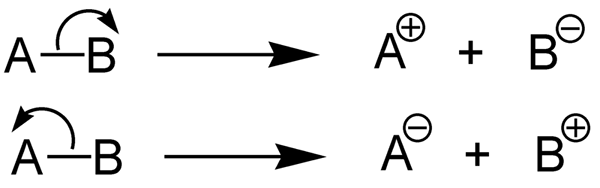
La energía de disociación del enlace heterolítico es la cantidad de energía requerida para clavar un enlace químico a través de la heterólisis. La heterólisis es la escisión de un enlace químico de manera asimétrica. La heterólisis forma cationes y aniones. Esto se debe a que, en la heterólisis, el par de electrones de unión es tomado por el átomo electronegativo (se convierte en el anión), mientras que el otro átomo no toma electrones (forma el catión).

Figura 2: Heterólisis de enlaces químicos
En comparación con la homólisis de una molécula, la heterólisis de la misma molécula es un valor diferente del de la homólisis. Esto significa que la energía de disociación del enlace homolítico de un compuesto es diferente de la energía de disociación del enlace heterolítico de la misma molécula.
Ej: Consideremos la escisión del enlace H-H en la molécula de hidrógeno.
Disociación del enlace homolítico: H2 → H ● +H ● (la energía de disociación de enlaces es de 104 kcal/mol)
Disociación del enlace heterolítico: H2 → H+ + H- (La energía de disociación de enlaces es de 66 kcal/mol)
¿Cuál es la diferencia entre la energía de disociación del enlace homolítico y heterolítico??
Energía de disociación de enlaces homolíticos vs heterolíticos | |
| El enlace homolítico La energía de disociación es la cantidad de energía requerida para disociar un enlace químico a través de la hemólisis. | La energía de disociación del enlace heterolítico es la cantidad de energía requerida para clavar un enlace químico a través de la heterólisis. |
| Producto | |
| La energía de disociación del enlace homolítico se asocia con la formación de radicales por la escisión de enlaces químicos. | La energía de disociación del enlace heterolítico se asocia con la formación de cationes y aniones por la escisión de enlaces químicos. |
Resumen -Energía de disociación de enlaces homolíticos vs heterolíticos
La energía de disociación del enlace es la energía requerida para escindir un enlace químico a través de la homólisis en condiciones estándar. Hay dos tipos de divisiones de enlaces como homólisis y heterólisis. La escisión del enlace homolítico forma radicales, mientras que la escisión del enlace heterolítico forma cationes y aniones. La diferencia clave entre la energía de disociación del enlace homolítico y heterolítico es que el valor de la energía de disociación del enlace homolítico es diferente del de la energía de disociación del enlace heterolítico para el mismo compuesto.
Referencia:
1. "Energía de disociación de enlaces."Wikipedia, Fundación Wikimedia, 28 de febrero. 2018, disponible aquí.
2. "Heterólisis (química)."Wikipedia, Fundación Wikimedia, 19 de febrero. 2018, disponible aquí.
3. "Energías de disociación de enlaces = escisión homolítica."Master Organic Chemistry RSS, disponible aquí.
Imagen de cortesía:
1. "Homólisis (química)" de Jürgen Martens - Jürgen Martens (dominio público) a través de Commons Wikimedia
2. "Heterólisis (química)" de [Jürgen Martens - Jürgen Martens (CC By -SA 3.0) a través de Commons Wikimedia


