Diferencia entre los orbitales híbridos y degenerados
El diferencia clave entre los orbitales híbridos y degenerados es que Los orbitales híbridos son nuevos orbitales que se forman a partir de la mezcla de dos o más orbitales, mientras que los orbitales degenerados existen originalmente en un átomo.
Como su nombre lo indica, un orbital híbrido es un híbrido de dos o más orbitales. Aunque el nombre del orbital degenerado parece igual, no son orbitales recién formados, ya existen en un átomo. Además, todos los orbitales híbridos en una molécula tienen la misma energía, mientras que los orbitales degenerados en un átomo tienen la misma energía.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los orbitales híbridos?
3. ¿Qué son los orbitales degenerados?
4. Comparación lado a lado: orbitales híbridos vs degenerados en forma tabular
5. Resumen
¿Qué son los orbitales híbridos??
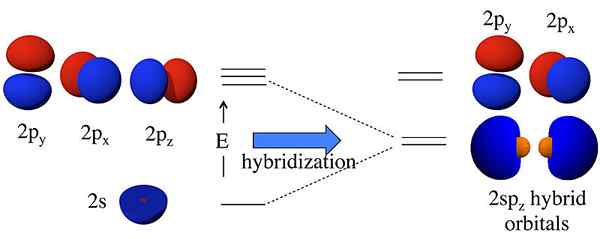
Los orbitales híbridos son orbitales formados por la combinación de dos o más orbitales atómicos. Llamamos a esta combinación de hibridación del proceso. Antes de la formación de estos orbitales, los orbitales atómicos pueden tener diferentes energías, pero después de la formación, todos los orbitales tienen la misma energía. Por ejemplo, un orbital atómico S y un orbital atómico P pueden combinarse para formar dos orbitales SP. Los orbitales atómicos S y P tienen diferentes energías (energía de S < energy of p). But, hybridization results in the formation of two sp orbitals having the same energy; this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

Figura 01: Hibridación SP
La idea de la hibridación entró por primera vez en la discusión porque los científicos observaron que la teoría del enlace de valencia no puede predecir correctamente la estructura de algunas moléculas como el CH4. Aunque el átomo de carbono tiene solo dos electrones no apareados según su configuración de electrones, puede formar cuatro enlaces covalentes. Para formar cuatro enlaces, debe haber cuatro electrones no apareados. La única forma de explicar este fenómeno era pensar que los orbitales de S y P del átomo de carbono se fusionan entre sí para formar nuevos orbitales llamados orbitales híbridos, que tienen la misma energía. Aquí, uno s + tres p da 4 sp3 orbitales. Por lo tanto, los electrones llenan estos orbitales híbridos de manera uniforme (un electrón por orbital híbrido), obedeciendo la regla del Hund. Luego, hay cuatro electrones para la formación de cuatro enlaces covalentes con cuatro átomos de hidrógeno.
¿Qué son los orbitales degenerados??
Los orbitales de denigración son los orbitales atómicos que tienen la misma energía. Por ejemplo, en la subshell P orbital, hay tres orbitales atómicos que difieren entre sí de acuerdo con la disposición espacial. Aunque la energía de estos tres orbitales P es la misma, están dispuestas de manera diferente; Por lo tanto, los llamamos orbitales degenerados.
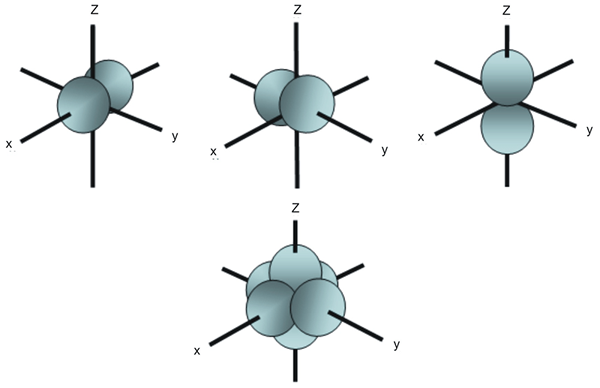
Figura 02: disposición espacial de tres orbitales P
Sin embargo, en presencia de un campo magnético externo, podemos eliminar la degeneración. Es porque los orbitales degenerados tienden a obtener diferentes energías en presencia de este campo magnético externo, y ya no son orbitales degenerados. Además, cinco orbitales D en la subshell D también son orbitales degenerados porque tienen la misma energía.
¿Cuál es la diferencia entre los orbitales híbridos y degenerados??
La diferencia clave entre los orbitales híbridos y degenerados es que los orbitales híbridos son nuevos orbitales formados por la mezcla de dos o más orbitales, mientras que los orbitales degenerados son orbitales que originalmente existen en un átomo. Además, los orbitales híbridos son orbitales moleculares, mientras que los orbitales degenerados son orbitales atómicos. Además, los orbitales híbridos son orbitales moleculares que tienen la misma energía, mientras que los orbitales degenerados son orbitales atómicos que tienen la misma energía. Por ejemplo, SP, SP2 y SP3 Los orbitales son orbitales híbridos, mientras que tres orbitales P en la subshell P.

Resumen -Orbitales híbridos vs degenerados
Los orbitales híbridos son orbitales moleculares, mientras que los orbitales degenerados son orbitales atómicos. La diferencia clave entre los orbitales híbridos y degenerados es que los orbitales híbridos se forman mediante la mezcla de dos o más orbitales, mientras que los orbitales degenerados existen originalmente en un átomo.
Referencia:
1. Helmenstine, Anne Marie. "Definición orbital híbrida."Thinkco, junio. 22, 2018, disponible aquí.
Imagen de cortesía:
1. "Hibridación SP" de TEM5PSU - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia
2. "PX PY PZ Orbitals" de la Fundación CK -12 - Archivo: Química de la escuela secundaria.PDF, página 268 (CC BY-SA 3.0) a través de Commons Wikimedia


