Diferencia entre hibridación y superposición
El diferencia clave entre la hibridación y la superposición es que La hibridación se refiere a la formación de nuevos orbitales híbridos a través de la superposición de orbitales atómicos, mientras que la superposición se refiere a la mezcla de orbitales atómicos.
Los orbitales son estructuras hipotéticas que se pueden llenar con electrones. Según diferentes descubrimientos, los científicos propusieron diferentes formas para estos orbitales. Hay tres tipos principales de orbitales: orbitales atómicos, orbitales moleculares y orbitales híbridos. Formulario de orbitales híbridos a través del proceso de hibridación. La hibridación y la superposición son dos conceptos químicos relacionados. La superposición de los orbitales atómicos ocurre durante la hibridación.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la hibridación?
3. Que es superpuesto
4. Comparación de lado a lado: hibridación frente a superposición en forma tabular
5. Resumen
¿Qué es la hibridación??
La hibridación es un proceso químico en el que se forman orbitales híbridos a partir de la mezcla de orbitales atómicos. La teoría de la hibridación es una técnica que utilizamos para describir la estructura orbital de una molécula. Básicamente, la hibridación es la formación de orbitales híbridos mediante la mezcla de dos o más orbitales atómicos. La orientación de estos orbitales determina la geometría de la molécula. Es una expansión de la teoría de la valencia del enlace.
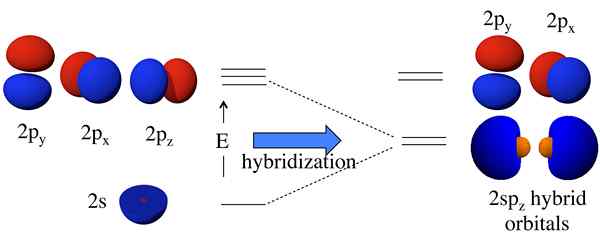
Antes de la formación de los orbitales atómicos, tienen diferentes energías, pero después de la formación, todos los orbitales tienen la misma energía. Por ejemplo, un orbital atómico S y un orbital atómico P pueden combinarse para formar dos orbitales SP. Los orbitales atómicos S y P tienen diferentes energías (energía de S < energy of p). But, after hybridization, it forms two sp orbitals which have the same energy, and this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

Figura 01: Formación de orbitales híbridos
La idea de la hibridación entró por primera vez en la discusión porque, dado que la teoría del enlace de valencia no pudo predecir correctamente la estructura de algunas moléculas como el CH4. Aunque el átomo de carbono en CH4 Tiene solo dos electrones no apareados según su configuración de electrones, puede formar cuatro enlaces covalentes. Para formar cuatro enlaces, debe haber cuatro electrones no apareados.
La única forma de explicar este fenómeno era pensar que los orbitales de S y P del átomo de carbono se fusionan entre sí para formar nuevos orbitales llamados orbitales híbridos que tienen la misma energía. Aquí, uno s + tres p da 4 sp3 orbitales. Por lo tanto, los electrones llenan estos orbitales híbridos de manera uniforme (un electrón por orbital híbrido), obedeciendo la regla del Hund. Por lo tanto, hay cuatro electrones para la formación de cuatro enlaces covalentes con cuatro átomos de hidrógeno.
Que es superpuesto?
La superposición es el proceso químico en el que los orbitales atómicos se superponen entre sí. En otras palabras, es la concentración de orbitales en el espacio entre diferentes átomos, lo que conduce a la formación de enlaces químicos. Linus Pauling desarrolló por primera vez la teoría sobre esta superposición orbital. Explicó los ángulos de enlace molecular en diferentes moléculas, y este concepto fue la base de la teoría de la hibridación.
¿Cuál es la diferencia entre hibridación y superposición??
La hibridación y la superposición son dos conceptos químicos relacionados. La diferencia clave entre la hibridación y la superposición es que la hibridación es la formación de nuevos orbitales híbridos a través de la superposición de orbitales atómicos, mientras que la superposición es la mezcla de orbitales atómicos. Además, en el proceso de hibridación, los orbitales de los mismos átomos se superponen para formar orbitales híbridos, mientras que en el proceso de superposición, los orbitales del mismo átomo se superponen para formar orbitales y orbitales híbridos de diferentes átomos para formar enlaces químicos.
La siguiente infografía presenta más hechos sobre la diferencia entre la hibridación y la superposición.
Resumen -Hibridación frente a superposición
La hibridación y la superposición son dos conceptos químicos relacionados. En resumen, la diferencia clave entre la hibridación y la superposición es que la hibridación se refiere a la formación de nuevos orbitales híbridos a través de la superposición de orbitales atómicos, mientras que la superposición significa la mezcla de orbitales atómicos.
Referencia:
1. Helmenstine, Anne Marie. "Definición orbital híbrida."Thinkco, junio. 22, 2018, disponible aquí.
Imagen de cortesía:
1. "Hibridación SP" de TEM5PSU - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia


