Diferencia entre el ácido hidrofluorico y el ácido clorhídrico

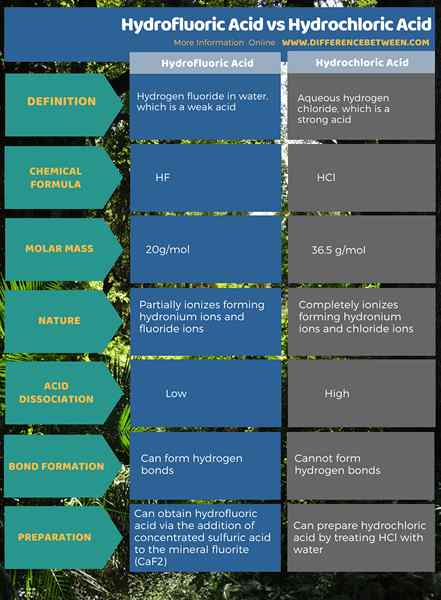
El diferencia clave entre el ácido hidrofluorico y el ácido clorhídrico es que el El ácido hidrofluorico es un ácido débil, mientras que el ácido clorhídrico es un ácido fuerte. Además, el ácido hidrofluórico es capaz de formar enlaces de hidrógeno, mientras que el ácido clorhídrico no puede formar enlaces de hidrógeno.
Además, otra diferencia importante entre el ácido hidrofluorico y el ácido clorhídrico está en su estructura molecular. El La molécula de ácido hidrofluorico tiene un ion fluoruro, mientras que la molécula de ácido clorhídrico tiene un ion cloruro. Además, tanto el ácido hidrofluórico como el clorhídrico son donantes de protones. Por lo tanto, estas moléculas ácidas pueden ionizarse en medios acuosos que liberan protones (H+). Estos protones causan la acidez en el medio acuoso.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el ácido hidrofluorico?
3. ¿Qué es el ácido clorhídrico?
4. Comparación de lado a lado: ácido hidrofluorico frente a ácido clorhídrico en forma tabular
5. Resumen
¿Qué es el ácido hidrofluorico??
El ácido hidrofluorico es fluoruro de hidrógeno en agua. El fluoruro de hidrógeno es un compuesto ácido que tiene la fórmula química HF y la masa molar de 20 g/mol. Además, este ácido es un compuesto inicial para casi todos los compuestos que contienen flúor. Ej: Teflón. Este ácido es altamente reactivo con vidrio y moderadamente reactivo con metales. Por lo tanto, se almacena en recipientes de plástico. Sin embargo, un contenedor hecho de teflón es ligeramente permeable a este ácido.

Figura 01: una botella de ácido hidrofluórico
El ácido hidrofluorico es un ácido débil. Eso es porque tiene una constante de disociación más baja. La disociación de este ácido proporciona iones de hidronio (combinación de protones y moléculas de agua forman iones de hidronio) e iones de fluoruro. Entre los ácidos hidrohálicos, este es el único ácido débil. Podemos obtener este ácido mediante la adición de ácido sulfúrico concentrado a la fluorita mineral (CAF2).
¿Qué es el ácido clorhídrico??
El ácido clorhídrico es un cloruro de hidrógeno acuoso. El cloruro de hidrógeno tiene la fórmula química HCl, y su masa molar es 36.5 g/mol. Este ácido tiene un olor picante. Además, es importante como compuesto inicial para muchos productos químicos inorgánicos como el cloruro de vinilo.

Figura 02: una botella de ácido clorhídrico
A diferencia de HF, HCl es un ácido fuerte que puede ionizarse completamente en el medio acuoso, formando iones de hidronio e iones de cloruro. Por lo tanto, este ácido tiene un alto valor de KA. Podemos preparar este ácido tratando HCL con agua.
¿Cuál es la diferencia entre el ácido hidrofluorico y el ácido clorhídrico??
El ácido hidrofluorico es fluoruro de hidrógeno en agua. Es un ácido débil, y puede formar enlaces de hidrógeno. El ácido clorhídrico es cloruro de hidrógeno acuoso. Es un ácido fuerte, y no puede formar enlaces de hidrógeno. Esta es la principal diferencia entre el ácido hidrofluorico y el ácido clorhídrico.
Además, la molécula de ácido hidrofluorico tiene un ion fluoruro, mientras que la molécula de ácido clorhídrico tiene un ion de cloruro. Sin embargo, ambos son ácidos hidrohálicos que tienen un átomo de hidrógeno unido a un halógeno. Además, el ácido hidrofluorico es el único ácido débil entre otros ácidos hidrohálicos.
Resumen -ácido hidrofluorico frente a ácido clorhídrico
El ácido hidrofluórico e hidrocórico son ácidos hidrohálicos porque ambos compuestos ácidos tienen un haluro unido a un átomo de hidrógeno. Además, hay muchas diferencias entre estos dos ácidos. La diferencia entre el ácido hidrofluorico y el ácido clorhídrico es que el ácido hidrofluorico es un ácido débil y puede formar enlaces de hidrógeno, mientras que el ácido clorhídrico es un ácido fuerte y no es capaz de formar enlaces de hidrógeno.
Referencia:
1. "Ácido hidrofluorico."Centro Nacional de Información de Biotecnología. Base de datos de compuestos de pubChem, u.S. Biblioteca Nacional de Medicina. Disponible aquí
2. "Ácido clorhídrico."Centro Nacional de Información de Biotecnología. Base de datos de compuestos de pubChem, u.S. Biblioteca Nacional de Medicina. Disponible aquí
Imagen de cortesía:
1.'Fluoruro de hidrógeno' por usuario: Dorgan-autopografiado, (CC BY-SA 3.0) a través de Commons Wikimedia
2.'Ácido clorhídrico 05' (dominio público) a través de Commons Wikimedia


