Diferencia entre el enlace de hidrógeno y el enlace iónico
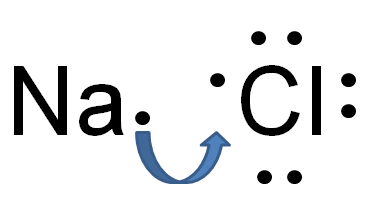
El diferencia clave entre el enlace de hidrógeno y el enlace iónico es que la unión iónica existe entre aniones y cationes permanentes, mientras que los enlaces de hidrógeno existen entre cargas negativas positivas y parciales parciales y parciales.
Los enlaces químicos mantienen juntos átomos y moléculas. Los enlaces son importantes para determinar el comportamiento químico y físico de las moléculas y los átomos. Según lo propuesto por el químico estadounidense g.norte.Lewis, los átomos son estables cuando contienen ocho electrones en su carcasa de valencia. La mayoría de los átomos tienen menos de ocho electrones en sus conchas de valencia (excepto los gases nobles en el grupo 18 de la tabla periódica); Por lo tanto, no son estables. Estos átomos tienden a reaccionar entre sí para volverse estables. Por lo tanto, cada átomo puede lograr una configuración electrónica de gas noble. Los enlaces iónicos son uno de esos enlaces químicos, que conecta los átomos en los compuestos químicos. Los enlaces de hidrógeno son atracciones intermoleculares entre las moléculas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el enlace de hidrógeno?
3. ¿Qué es el enlace iónico?
4. Comparación de lado a lado: enlace de hidrógeno frente a enlace iónico en forma tabular
5. Resumen
¿Qué es el enlace de hidrógeno??
Cuando el hidrógeno se une a un átomo electronegativo como flúor, oxígeno o nitrógeno, creará un enlace polar. Debido a la electronegatividad, los electrones en el enlace se sienten atraídos por el átomo electronegativo más que al átomo de hidrógeno. Por lo tanto, el átomo de hidrógeno obtendrá una carga positiva parcial, mientras que el átomo más electronegativo obtendrá una carga negativa parcial. Cuando dos moléculas que tienen esta separación de carga están cerca, una fuerza de atracción aumenta entre el hidrógeno y el átomo cargado negativamente. Llamamos a este enlace de hidrógeno.
Los enlaces de hidrógeno son relativamente más fuertes que otras interacciones dipolares, y determinan el comportamiento molecular. Por ejemplo, las moléculas de agua tienen unión de hidrógeno intermolecular. Una molécula de agua puede formar cuatro enlaces de hidrógeno con otra molécula de agua. Dado que el oxígeno tiene dos pares solitarios, puede formar dos enlaces de hidrógeno con hidrógeno cargado positivamente. Entonces, podemos llamar a las dos moléculas de agua como un dímero. Cada molécula de agua puede unirse con otras cuatro moléculas debido a la capacidad de enlace de hidrógeno. Da como resultado un punto de ebullición más alto para el agua, a pesar de que una molécula de agua tiene un peso molecular bajo. Por lo tanto, la energía necesaria para romper los enlaces de hidrógeno cuando van a la fase gaseosa es alta.
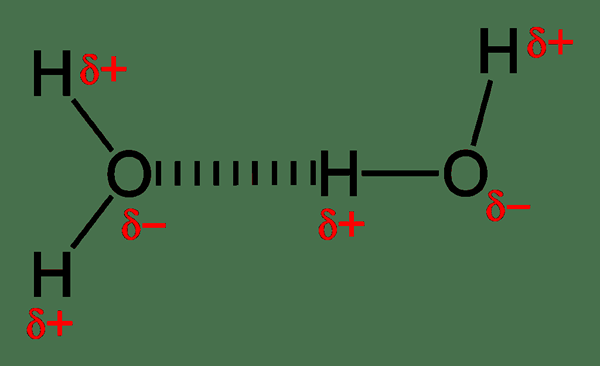
Figura 01: enlaces de hidrógeno entre las moléculas de agua
Además, los enlaces de hidrógeno determinan la estructura cristalina del hielo. La disposición única de la red de hielo lo ayuda a flotar sobre el agua; Por lo tanto, proteger la vida acuática en el período de invierno. Aparte de esto, la unión de hidrógeno juega un papel vital en los sistemas biológicos. La estructura tridimensional de las proteínas y el ADN se basa únicamente en enlaces de hidrógeno. Además, los enlaces de hidrógeno se pueden destruir mediante calefacción y fuerzas mecánicas.
¿Qué es el enlace iónico??
Los átomos pueden ganar o perder electrones y formar partículas cargadas negativas o positivas, respectivamente. Estas partículas se llaman iones. Hay interacciones electrostáticas entre los iones. La unión iónica es la fuerza atractiva entre estos iones con carga opuesta. La fuerza de las interacciones electrostáticas está en gran medida influenciada por los valores de electronegatividad de los átomos en un enlace iónico. La electronegatividad da una medida de la afinidad de los átomos por los electrones. Un átomo con alta electronegatividad puede atraer electrones de un átomo con baja electronegatividad para formar un enlace iónico.
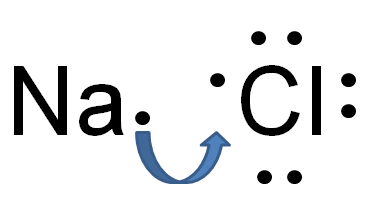
Figura 02: Formación de enlace iónico en cloruro de sodio
Por ejemplo, el cloruro de sodio tiene un enlace iónico entre el ion de sodio y el ion de cloruro. El sodio es un metal; Por lo tanto, tiene una electronegatividad muy baja (0.9) en comparación con el cloro (3.0). Debido a esta diferencia de electronegatividad, el cloro puede atraer un electrón de sodio y formar iones Cl y Na+. Debido a esto, ambos átomos obtienen la configuración electrónica de gas noble estable. Cl- y Na+ se mantienen unidos por fuerzas electrostáticas atractivas muy fuertes, formando así un enlace iónico.
¿Cuál es la diferencia entre el enlace de hidrógeno y el enlace iónico??
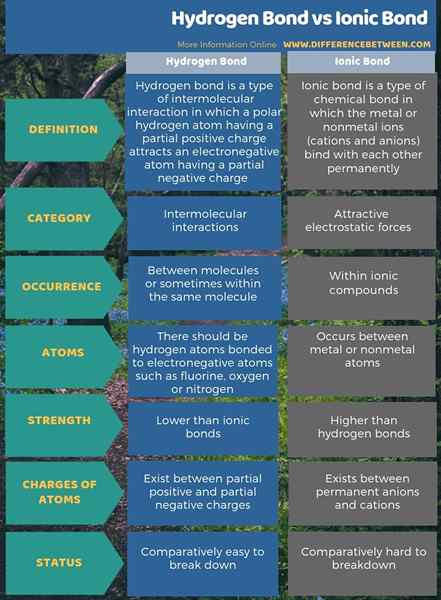
Los enlaces de hidrógeno son atracciones intermoleculares, mientras que los enlaces iónicos son fuerzas electrostáticas atractivas. La diferencia clave entre el enlace de hidrógeno y el enlace iónico es que la unión iónica existe entre aniones y cationes permanentes, mientras que los enlaces de hidrógeno existen entre cargas negativas positivas y parciales parciales y parciales. Además, los enlaces iónicos son más fuertes que los enlaces de hidrógeno.
Además, los enlaces de hidrógeno ocurren cuando hay un átomo de hidrógeno y un átomo electronegativo, mientras que se producen enlaces iónicos entre cualquier metal y átomo no metal. Entonces, esta es una diferencia significativa entre el enlace de hidrógeno y el enlace iónico. Además, una diferencia adicional entre el enlace de hidrógeno y el enlace iónico es que los enlaces de hidrógeno son fáciles de romper porque son fuerzas de atracción intermoleculares o intramoleculares, pero los enlaces iónicos son fuertes enlaces químicos que son difíciles de romper.
Resumen: enlace de hidrógeno y enlace iónico
Los enlaces iónicos ocurren dentro de los compuestos iónicos. Los enlaces de hidrógeno son enlaces intermoleculares. La diferencia clave entre el enlace de hidrógeno y el enlace iónico es que la unión iónica existe entre aniones y cationes permanentes, mientras que los enlaces de hidrógeno existen entre cargas negativas positivas y parciales parciales y parciales.
Referencia:
1. Helmenstine, Anne Marie. “Definición y ejemplos de enlaces de hidrógeno."Thoughtco, puede. 6, 2019, disponible aquí.
2. Helmenstine, Anne Marie. “Definición de enlaces iónicos."Thinkco, Jan. 26, 2019, disponible aquí.
Imagen de cortesía:
1. "Bonding-en-Water-2D" (dominio público) a través de Commons Wikimedia
2. "Bono iónico NaCl" por Mhowison - Trabajo propio (dominio público) a través de Commons Wikimedia


