Diferencia entre la hidrólisis y la condensación

Hidrólisis vs condensación
La condensación y la hidrólisis son dos tipos de reacciones químicas, que están involucradas en la formación de enlaces y la rotura de enlaces. La condensación es el reverso de la hidrólisis. Estos dos tipos de reacciones se encuentran comúnmente dentro de los sistemas biológicos, y también utilizamos estas reacciones para obtener muchos productos comercialmente importantes.
Condensación
Las reacciones de condensación son un tipo de reacción química donde las moléculas pequeñas se unen para formar una sola molécula grande. La reacción tiene lugar dentro de dos grupos funcionales en las moléculas. Otro rasgo característico de una reacción de condensación es que se pierde una molécula pequeña durante la reacción. Esta molécula puede ser agua, cloruro de hidrógeno, ácido acético, etc. Si la molécula perdida es agua, esos tipos de reacciones de condensación se conocen como reacciones de deshidratación. Dado que las moléculas reactivas son más pequeñas y la molécula del producto es muy grande, la densidad de los productos siempre será mayor que las reacciones en las reacciones de condensación. Las reacciones de condensación tienen lugar de varias maneras. Por ejemplo, podemos dividirlos ampliamente en dos tipos como reacciones de condensación intermolecular y reacciones de condensación intra-molecular. Si los dos grupos funcionales residen en la misma molécula, se conocen como condensaciones intra-moleculares. Por ejemplo, la glucosa tiene una estructura lineal de la siguiente manera.
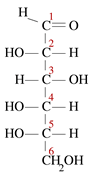
En una solución, la mayoría de las moléculas están en una estructura cíclica. Cuando se forma una estructura cíclica, el -oh en el carbono 5 se convierte en el enlace de éter, para cerrar el anillo con carbono 1. Esto forma una estructura de anillo hemiacetal de seis miembros. Durante esta reacción de condensación intra-molecular, se repele una molécula de agua y se forma un enlace de éter. Las reacciones intermoleculares producen muchos productos útiles y comunes. Durante esto, la reacción tiene lugar entre los grupos funcionales de dos moléculas separadas. Por ejemplo, al formar una macromolécula como la proteína, los aminoácidos se condensan. Se libera una molécula de agua y se forma un enlace de amida que se conoce como unión peptídica. Cuando se unen dos aminoácidos, se forma un dipéptido, y cuando se unen muchos aminoácidos se llama polipéptido. El ADN y el ARN también son dos macromoléculas formadas como resultado de reacciones de condensación entre los nucleótidos. Las reacciones de condensación producen moléculas muy grandes y, a veces, las moléculas no son tan grandes. Por ejemplo: en la reacción de esterificación entre un alcohol y un ácido carboxílico, una molécula de éster pequeña si se forma si se forma. La condensación es importante en la formación de polímeros. Los polímeros son moléculas grandes, que tienen la misma unidad estructural que se repite una y otra vez. Las unidades repetidas se llaman monómeros. Estos monómeros están unidos entre sí con enlaces covalentes para formar un polímero.
Hidrólisis
Esta es una reacción en la que se rompe un enlace químico usando una molécula de agua. Durante esta reacción, una molécula de agua se divide en un protón y un ion hidróxido. Y luego se agregan estos dos iones a las dos partes de la molécula donde se rompe el enlace. Por ejemplo, lo siguiente es un éster. El vínculo éster es entre -co y -o.
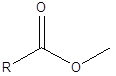
En la hidrólisis, el protón del agua se suma al lado -o, y el ion hidróxido se suma al lado -co. Por lo tanto, como resultado de la hidrólisis, se formará un alcohol y un ácido carboxílico que fueron los reactivos al formar el éster.
| ¿Cuál es la diferencia entre hidrólisis y condensación?? • La hidrólisis es el reverso de la condensación. • Las reacciones de condensación hacen enlaces químicos, mientras que la hidrólisis rompe los enlaces químicos. • Los polímeros se realizan mediante reacciones de condensación, y se rompen por reacciones de hidrólisis. • Durante las reacciones de condensación, se puede liberar la molécula de agua. En las reacciones de hidrólisis, la molécula de agua se incorpora a la molécula. |


