Diferencia entre los aminoácidos hidrofóbicos e hidrofílicos
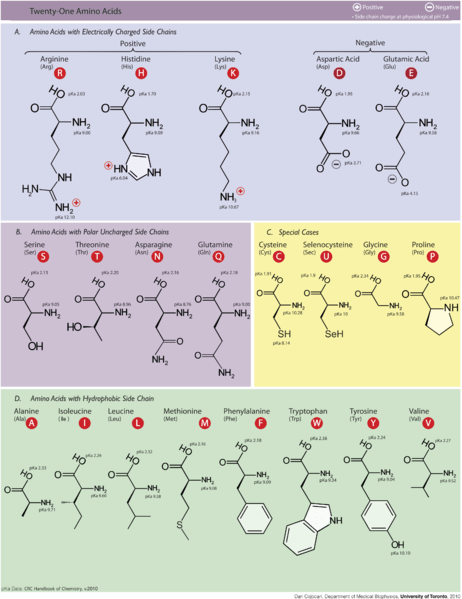
El diferencia clave entre los aminoácidos hidrófobos e hidrofílicos es que el Los aminoácidos hidrofóbicos no son polares, mientras que los aminoácidos hidrofílicos son polares.
Los aminoácidos son los bloques de construcción de las proteínas. Una proteína es una molécula de polímero gigante que es un componente esencial de todos los organismos vivos. Además, los aminoácidos se encuentran principalmente en dos tipos como aminoácidos esenciales y no esenciales. Además, podemos clasificarlos como aminoácidos hidrofílicos e hidrofóbicos, dependiendo de su naturaleza fisicoquímica. Son diferentes entre sí principalmente en función de la polaridad.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los aminoácidos hidrófobos?
3. ¿Qué son los aminoácidos hidrofílicos?
4. Comparación de lado a lado - Aminoácidos hidrofóbicos vs hidrófilos en forma tabular
5. Resumen
¿Qué son los aminoácidos hidrófobos??
Los aminoácidos hidrofóbicos son un tipo de aminoácidos con naturaleza no polar. Del mismo modo, el nombre "hidrofóbico" se deriva porque no interactúa con el agua ("Hydro" - agua). El agua es un disolvente polar. Dado que estos aminoácidos no son polares, no pueden disolverse en el agua.

Figura 01: Aminoácidos esenciales
Por lo tanto, la naturaleza hidrofóbica de estos compuestos surge debido a las cadenas laterales que tienen en su estructura química. Un aminoácido tiene la fórmula general en la que se une un átomo de carbono central con un átomo de hidrógeno, un grupo carboxilo, un grupo de amina y un grupo lateral (grupo R). Este grupo R puede ser simplemente un átomo (átomo de hidrógeno) o una cadena lateral larga. Por lo tanto, si la cadena lateral es muy larga y consiste principalmente en átomos de carbono e hidrógeno, son hidrófobos. Además, tienen pequeños momentos dipolares. Por lo tanto, tienden a repeler del agua.
Además, los aminoácidos hidrófobos entre los aminoácidos esenciales son los siguientes.
- Glicina
- Alanina
- Valina
- Leucina
- Isoleucina
- Prolina
- Fenilalanina
- Metionina
- Triptófano
¿Qué son los aminoácidos hidrofílicos??
Los aminoácidos hidrofílicos son un tipo de aminoácidos con naturaleza polar. El nombre "hidrófilo" deriva porque atrae agua. Dado que el agua es un disolvente polar y estos aminoácidos también son polares, pueden disolverse en agua.
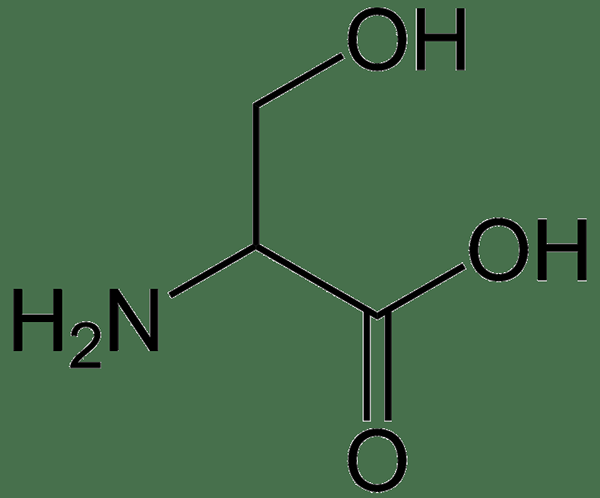
Figura 02: Aminoácidos hidrofílicos: serina
Los aminoácidos hidrofílicos contienen cadenas laterales cortas o cadena lateral con grupos hidrofílicos. Por lo general, estos aminoácidos ocurren en la superficie de las moléculas de proteínas, y tienen grandes momentos dipolares. En consecuencia, tienden a atraer agua.
Además, los principales aminoácidos hidrofílicos e esenciales son los siguientes:
- Serina
- Treonina
- Cisteína
- Asparagino
- Glutamina
- Tirosina
¿Cuál es la diferencia entre los aminoácidos hidrofóbicos e hidrofílicos??
Los aminoácidos hidrofóbicos son un tipo de aminoácidos que tienen una naturaleza no polar, mientras que los aminoácidos hidrófilos son un tipo de aminoácidos en los que tienen una naturaleza polar. Por lo tanto, esta es la diferencia clave entre los aminoácidos hidrofóbicos e hidrofílicos. Además, los aminoácidos hidrofóbicos tienen cadenas laterales largas con átomos de carbono e hidrógeno, mientras que los aminoácidos hidrofílicos tienen cadenas laterales cortas o cadena lateral con grupos hidrofílicos. Como otra diferencia importante entre los aminoácidos hidrofóbicos e hidrofílicos, los hidrófobos ocurren en el centro de las proteínas, mientras que los aminoácidos hidrofílicos están en la superficie.
La siguiente ilustración muestra una descripción detallada sobre la diferencia entre aminoácidos hidrófobos e hidrofílicos.
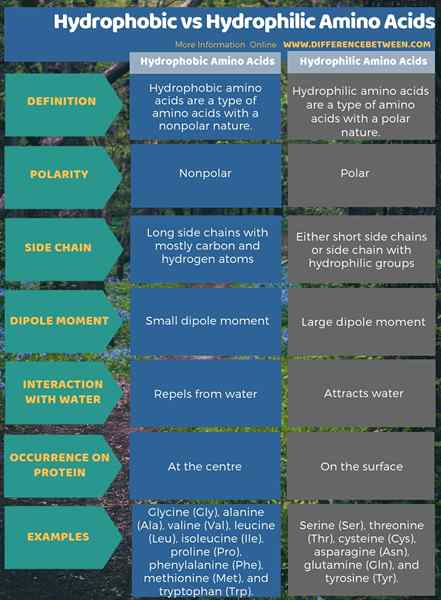
Resumen -Aminoácidos hidrofóbicos vs hidrófilos
En resumen, los aminoácidos son los componentes básicos de las proteínas. Además, según la polaridad, hay dos tipos como aminoácidos hidrófilos e hidrofóbicos. La diferencia clave entre los aminoácidos hidrofóbicos e hidrofílicos es que los aminoácidos hidrofóbicos no son polares, mientras que los aminoácidos hidrofílicos son polares.
Referencia:
1. Reddy, Michael K. "Aminoácidos."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 30 de octubre. 2018. Disponible aquí
Imagen de cortesía:
1."Aminoácidos" de Dan COJOCAR (CC BY-SA 3.0) a través de Commons Wikimedia
2."Serina simple" de Sten André - Trabajo propio, (dominio público) a través de Commons Wikimedia


