Diferencia entre la ley de gas ideal y la ley de gas real
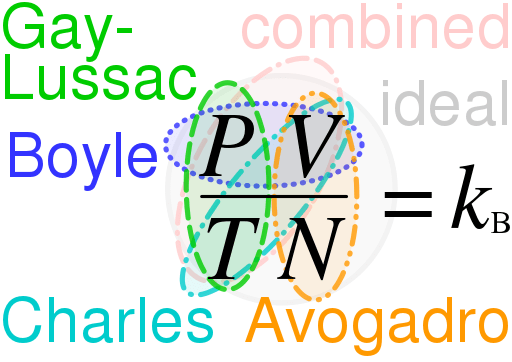
El diferencia clave Entre la ley de gas ideal y la ley de gas real es que La ley de gas ideal describe el comportamiento de un gas teórico, mientras que la ley de gas real describe el comportamiento de los gases realmente ocurridos en el universo.
Un gas ideal es un gas teórico cuyas partículas de gas en movimiento al azar tienen colisiones completamente elásticas y ninguna otra interacción entre ellas. Según esta definición, podemos entender que estos gases ideales no pueden ocurrir en la naturaleza porque hay esencialmente interacciones entre las partículas de gas para cualquier gas que sepamos. De hecho, los gases que conocemos son gases reales.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ley de gas ideal?
3. ¿Qué es la ley de gas real?
4. Comparación de lado a lado - Ley de gas ideal frente a la ley de gas real en forma tabular
5. Resumen
¿Cuál es la ley de gas ideal??
La ley de gas ideal es una ecuación que describe el comportamiento de un gas ideal. Los gases ideales son hipotéticos, y estos gases ocurren solo en las teorías. Por lo tanto, utilizando la ley de gas ideal, podemos entender y estimar el comportamiento de muchos gases reales que conocemos. Sin embargo, tiene varias limitaciones. Además, esta ley es una combinación de varias otras leyes:
- Ley de Boyle
- Ley de Charles
- Ley de Avogadro
- Ley de Gay-Lussac
Cálculo
Básicamente, podemos dar la ley de gas ideal de la siguiente manera;
PV = NRT
Donde, p es presión, v es volumen y t es la temperatura del gas ideal. Aquí, "n" es el número de lunares del gas ideal y "r" es una constante: lo llamamos Gas ideal constante. Tiene un valor universal; El valor de R es el mismo para cualquier gas, y son 8.314 J/(K · Mol).
Además, podemos obtener diferentes derivadas de esta ley; forma molar, forma combinada, etc. Por ejemplo, dado que "n" es el número de lunares, podemos darlo usando el peso molecular del gas. La derivación es la siguiente.
n = m/m
donde, n es el número de moles de gas, M es la masa del gas y M es el peso molecular del gas. Usando la ecuación anterior,
PV = NRT
PV = (m/m) RT
Si queremos obtener la densidad del gas, podemos usar la ecuación anterior de la siguiente manera;
P = (m/vm) RT
P = ρRT/M
Además, si queremos obtener la ley de gas combinada de la ley de gas ideal, podemos derivarla de la siguiente manera; Para dos gases "1" y "2", la presión, el volumen y la temperatura son P1,V1,T1 y P2, V2 y T2. Luego, para los dos gases, podemos escribir dos ecuaciones como;
PAG1V1 = NRT1… (1)
PAG2V2 = NRT2 … (2)
Al dividir la ecuación (1) de la ecuación (2), obtenemos,
(PAG1V1)/(PAG2V2) = T1/ T2
Podemos reorganizar esta ecuación de la siguiente manera;
PAG1V1/ T1 = P2V2/ T2
¿Qué es la ley de gas real??
Ley de gas real, también llamada Ley de Van der Waals, se deriva de la ley de gas ideal para describir el comportamiento de los gases reales. Dado que los gases reales no pueden comportarse idealmente, la ley de gas real ha realizado cambios en los componentes de presión y volumen en la ley de gas ideal. Por lo tanto, podemos obtener el volumen y la presión de la siguiente manera:
Volumen de gas real = (Vmetro - b)
Presión de gas real = (p + a n2/V2)
Luego, podemos obtener la ley de gas real aplicando estos componentes modificados a la ley de gas ideal de la siguiente manera:
(P + a n2/V2) (Vmetro - b) = NRT
Donde, Vmetro es el volumen molar de gas, r es constante de gas universal, t es la temperatura del gas real, p es la presión.
¿Cuál es la diferencia entre la ley de gas ideal y la ley de gas real??
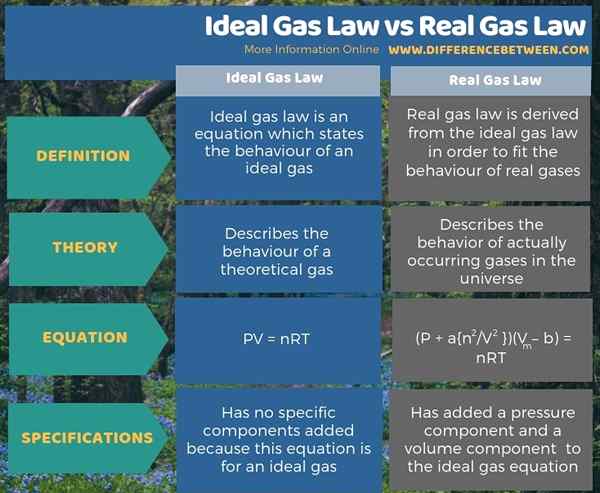
La ley de gas ideal es una ecuación que describe el comportamiento de un gas ideal. La ley de gas real se deriva de la ley de gas ideal para adaptarse al comportamiento de los gases reales. Entonces, la diferencia clave entre la ley de gas ideal y la ley de gas real es que la ley de gas ideal describe el comportamiento de un gas teórico, mientras que la ley de gas real describe el comportamiento de los gases realmente ocurridos en el universo.
Además, podemos derivar la ley de gas ideal de la ecuación pv = nrt, y la ley de gas real de la ecuación (p + a n2/V2) (Vmetro - b) = NRT.
Resumen -Ley de gas ideal frente a la ley de gas real
En resumen, un gas ideal es una sustancia hipotética que tiene colisiones completamente elásticas entre las partículas de gas, una propiedad que la mayoría de los gases reales que conocemos no muestran. La diferencia clave entre la ley de gas ideal y la ley de gas real es que la ley de gas ideal describe el comportamiento de un gas teórico, mientras que la ley de gas real describe el comportamiento de los gases realmente ocurridos en el universo.
Referencia:
1. Ley de gas ideal, hiperfísica. Universidad Estatal de Georgia, disponible aquí.
Imagen de cortesía:
1. "Relaciones ideales de la ley de gas" por CMGLEE - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia
2. "Ley de gas ideal" de Blyumj - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia


