Diferencia entre IGA e IgG
Diferencia clave - IGA VS IgG
Las inmunoglobulinas se denominan un tipo especial de proteínas globulares con una estructura compleja. El sistema vivo produce como una respuesta inmune específica secundaria al contactar con un antígeno de una partícula extraña o un organismo. Las inmunoglobulinas también se conocen como anticuerpos que son proteínas específicas producidas en respuesta a un antígeno. Las cinco clases principales de anticuerpos son - inmunoglobulina (IG) A, G, M, E, D. La inmunoglobulina A (IGA/IgG) es una inmunoglobulina secretora presente en las superficies mucosas, que consiste en una cadena J y un polipéptido secretor que participa en la función secretora. La inmunoglobulina G (IgG/IgG) está involucrada principalmente en la actuación contra patógenos extranjeros que incluyen bacterias y virus. El diferencia clave Entre IgA e IgG está la presencia y la ausencia del polipéptido secretor. IGA tiene un polipéptido secretor para facilitar la secreción a través de superficies mucosas, mientras que IgG no tiene una función secretora, por lo tanto, la cadena J está ausente.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es IGA?
3. ¿Qué es IgG?
4. Similitudes entre IgA e IgG
5. Comparación de lado a lado - IGA vs IgG en forma tabular
6. Resumen
¿Qué es IGA??
IgA es un tipo de inmunoglobulina que posee una función secretora. Por lo tanto, el IGA se puede encontrar principalmente en secreciones, incluida la saliva y la leche materna. Alrededor del 50% de la composición de proteínas del calostro es IGA. También es secretado por las capas mucosas del tracto gastrointestinal y el tracto respiratorio. Esto proporciona un mecanismo de protección contra los patógenos que ingresan al intestino o al tracto respiratorio.

Figura 01: Estructura de IGA
Hay dos subcases principales de IGA; IGA 1 e IGA2. IGA1 poseer una región de bisagra más larga y tiene un conjunto de aminoácidos duplicados adicionales en su estructura. Esta región de bisagra alargada aumenta la sensibilidad de IgA1 a las proteasas bacterianas. Por lo tanto, está presente principalmente en el suero. IGA2 está compuesto por una región de bisagra más corta, y carece de la estructura duplicada de aminoácidos. Por lo tanto, no tiene una mayor sensibilidad a la proteasa. IgA2 está presente principalmente en las membranas de secreto mucoso.
IGA forma una estructura de dímero que es una característica de este tipo de inmunoglobulina. Los monómeros se unen por una estructura conocida como la cadena J. La cadena J está vinculada a la estructura del dímero a través de enlaces de disulfuro. Un polipéptido se asocia con la estructura del dímero que actúa como el componente de polipéptidos secretores de IgA. La función principal de las IGA es proteger las capas de la mucosa de toxinas y productos químicos externas como las toxinas bacterianas y virales. IGA participa en una reacción neutralizante para neutralizar los productos de toxina.
¿Qué es IgG??
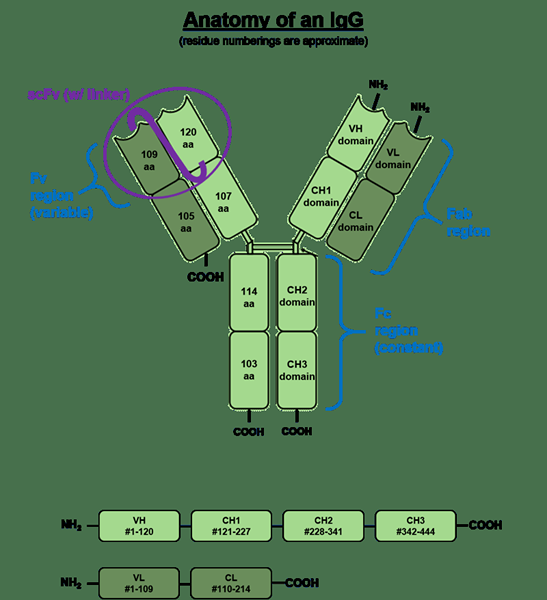
IgG es el tipo más común de inmunoglobulina presente en el sistema. También es la forma principal de inmunoglobulina circulatoria en el cuerpo. IgG es la única forma de inmunoglobulina que puede cruzar la placenta y alcanzar el feto. IgG consta de cuatro cadenas de polipéptidos; 2 cadenas pesadas y 2 cadenas ligeras que están unidas por enlaces de disulfuro entre cadena. Cada cadena pesada consiste en un dominio variable N-terminal (VH) y tres dominios constantes (CH1, CH2, CH3), con una "región de bisagra" adicional entre CH1 y CH2. Cada cadenas de luz consisten en un dominio variable N-terminal (VL) y un dominio constante (CL). La cadena ligera está asociada con los dominios VH y CH1 para formar un brazo fabuloso ("Fab" = unión al antígeno de fragmento), y las regiones V interactúan para formar la región de unión a antígeno. Más IgG también contiene una región altamente conservada que consiste en un aminoácido glucosilado en el 297th posición.

Figura 02: Estructura general de IgG
IgG tiene cuatro subcases principales, a saber, IgG1, IgG2, IgG3 e IgG4. IgG1 es la subclase más abundante. Es la respuesta de anticuerpos inmediato producida en el cuerpo sobre una infección por un agente bacteriano o viral. IgG2 se producen principalmente en respuesta a los antígenos capsulares bacterianos. Estos anticuerpos responden a los antígenos a base de carbohidratos. También puede actuar contra virus que poseen antígenos a base de carbohidratos. IgG3 es un anticuerpo proinflamatorio que generalmente se produce en respuesta a una infección viral. IgG3 es el anticuerpo principal producido en respuesta a los antígenos del grupo sanguíneo. Los anticuerpos IgG4 se producen en respuesta a infecciones prolongadas.
¿Cuáles son las similitudes entre IGA e IgG??
- Ambos se producen debido a una respuesta inmune secundaria.
- Ambos se producen en respuesta a antígenos o marcadores antigénicos producidos en
- Ambos son altamente específicos.
- Ambos consisten en cuatro cadenas de polipéptidos; 2 cadenas pesadas y 2 cadenas ligeras.
- Ambos participan en la lucha contra los patógenos bacterianos y virales.
¿Cuál es la diferencia entre IGA e IgG??
IGA vs IgG | |
| IgA es un anticuerpo presente en las secreciones y membranas mucosas y actúa contra los patógenos bacterianos y virales. | IgG es un anticuerpo producido como un mecanismo inmune secundario involucrado en la lucha contra las cepas virales y bacterianas patógenas. |
| Distribución | |
| IGA está en membranas mucosas y secreciones corporales como la saliva y la leche materna. | IgG está en todos los tejidos vasculares intra y extra. |
| Composición de la cadena pesada | |
| IGA tiene cadena pesada alfa. | IgG tiene cadena gamma pesada. |
| Concentración en suero | |
| En suero, la concentración de IgA es 0.6 - 3 mg/ml. | En suero, la concentración de IgG es de 6 - 13 mg/ml. |
| J cadena | |
| Presente en IGA. | Ausente en IgG. |
| Polipéptido secretor | |
| Presente en IGA. | Ausente en IgG. |
| Capacidad para cruzar la placenta | |
| IGA no puede cruzar la placenta. | IgG puede cruzar la placenta. |
Resumen -IGA VS IgG
Tanto IgA como IgG se producen en el cuerpo como una respuesta inmune secundaria. Son anticuerpos específicos que actúan uniéndose a un antígeno específico. La principal diferencia de las dos inmunoglobulinas se basa en la función de la secreción. IGA está presente es fluidos secretores y en membranas de secreto mucoso, mientras que IgG es la inmunoglobulina más abundante en el suero. Ambos tienen la capacidad de luchar contra los patógenos microbianos. Esta es la diferencia entre IGA e IgG.
Descargue la versión PDF de IGA vs IgG
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según la nota de cita. Descargue la versión PDF aquí Diferencia entre IGA e IgG
Referencia:
1.Schroeder, Harry W y Lisa Cavacini. "Estructura y función de las inmunoglobulinas."The Journal of Allergy and Clinical Inmunology, u.S. Biblioteca Nacional de Medicina, febrero. 2010. Disponible aquí
2.Woof, J M y M W Russell. "Relaciones de estructura y función en IGA."Nature News, Nature Publishing Group, 21 de septiembre. 2011. Disponible aquí
3.Janeway, Charles A y Jr. "La estructura de una molécula de anticuerpo típica."Inmunobiología: el sistema inmune en salud y enfermedad. 5ª edición., U.S. Biblioteca Nacional de Medicina, 1 de enero. 1970. Disponible aquí
Imagen de cortesía:
1.'Esquema IGA dimérico 01.'Por Mcortnghh - Trabajo propio, (CC By -SA 4.0) a través de Commons Wikimedia
2.'Anatomía de un IgG' por W: Usuario: Ajvincelli, dominio público a través de Commons Wikimedia


