Diferencia entre imide y amide
Diferencia clave: imide vs amide
Imides y amidas son compuestos orgánicos que contienen átomos C, H, N y O. Ambos compuestos contienen grupos acilo unidos a un átomo de nitrógeno. La diferencia clave entre imide y amide es que imide es Un compuesto orgánico compuesto por dos grupos acilo unidos al mismo átomo de nitrógeno, mientras que la amida es un compuesto orgánico compuesto por un grupo acilo unido a un átomo de nitrógeno.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es imide
3. Que es amide
4. Comparación de lado a lado: imide vs amida en forma tabular
5. Resumen
Que es imide?
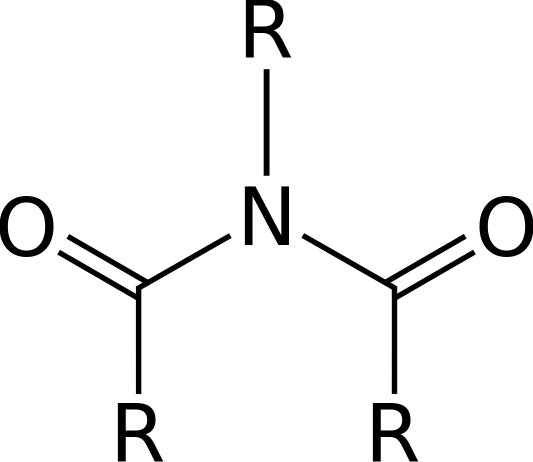
Un imide es un compuesto orgánico que consta de dos grupos acilo unidos al mismo átomo de nitrógeno. La estructura de un imide se asemeja a anhídridos ácidos. Estos compuestos son altamente polares y están bien disueltos en solventes polares.

Figura 1: Estructura general de un imide
La preparación de imides se realiza calentando ácidos dicarboxílicos con amoníaco (o aminas primarias). El tipo de reacción química involucrada en esta preparación es una reacción de condensación entre el ácido dicarboxílico y la amina que produce un imide.
Los imides formados a partir de amoníaco contienen un enlace N-H entre dos grupos acilo. Este enlace N-H da la capacidad de formar enlaces de hidrógeno. Este centro N-H es ácido. Esto conduce a la formación de sales de metal alcalino de imidas; Por ejemplo, ftalimida de potasio. Los átomos de nitrógeno en imidas no son tan básicos. Esto permite que los imides formen derivados de n-halo a través de la reacción entre un imide y un halógeno en presencia de una base.
Que es amide?
Una amida es un compuesto orgánico que consiste en un grupo acilo unido a un átomo de nitrógeno. También se llama un amida ácida. A veces este término se usa para nombrar la base conjugada de amoníaco (el NH2- anión). Las amidas más simples se derivan del amoníaco donde un átomo de hidrógeno del amoníaco es reemplazado por un grupo acilo. Las amidas complejas se forman a partir de aminas primarias y secundarias. Las amidas primarias se forman a partir de amoníaco, mientras que las amidas secundarias se forman a partir de aminas primarias, y las amidas terciarias se forman a partir de aminas secundarias. Las aminas terciarias no pueden participar en la formación de amidas.
Al considerar la estructura real de una amida, existe un doble enlace parcial entre el nitrógeno y el átomo de carbono del grupo acilo debido a la delocalización del par solitario en el átomo de nitrógeno. Esto significa que las amidas tienen estructuras de resonancia que determinan la estructura real de la amida.
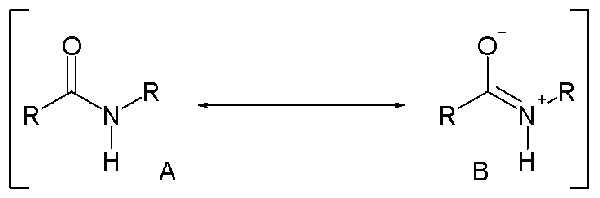
Figura 2: Estructuras de resonancia de una amida
Existen varios métodos para la síntesis de una amida. El método más básico es la reacción entre el ácido carboxílico y una amina. Esta reacción requiere una alta energía térmica ya que la energía de activación de la reacción es muy alta.
¿Cuál es la diferencia entre imide y amide??
Imide vs amide | |
| Un imide es un compuesto orgánico que consta de dos grupos acilo unidos al mismo átomo de nitrógeno. | Una amida es un compuesto orgánico que consiste en un grupo acilo unido a un átomo de nitrógeno. |
| Grupo acilo | |
| Un imide tiene al menos dos grupos acilo. | Una amida tiene al menos un grupo acilo. |
| Valor para materiales diamagnéticos | |
| Se puede preparar un imide calentando ácidos dicarboxílicos con amoníaco o aminas primarias. | Se puede preparar una amida mediante la reacción entre el ácido carboxílico y el amoníaco en presencia de una temperatura alta. |
Resumen - imide vs amide
Tanto las imidas como las amidas son compuestos orgánicos que contienen nitrógeno. La diferencia clave entre imida y amida es que imide es un compuesto orgánico compuesto por dos grupos acilo unidos al mismo átomo de nitrógeno, mientras que la amida es un compuesto orgánico compuesto por un grupo acilo unido a un átomo de nitrógeno.
Referencia:
1. "Imide."Wikipedia, Fundación Wikimedia, 3 de abril. 2018, disponible aquí.
2. "Amides."Bibliotecas de química, 11 mar. 2017, disponible aquí.
Imagen de cortesía:
1. "Amideresonance" de V8rik en el inglés Wikipedia (CC By-SA 3.0) a través de Commons Wikimedia
2. "Imide Functional Group" de CJP24 - Trabajo propio (dominio público) a través de Commons Wikimedia


