Diferencia entre dipolo inducido y dipolo permanente
El diferencia clave entre el dipolo inducido y el dipolo permanente es que El momento dipolar inducido puede cambiar cuando se cambian los factores que afectan el momento dipolar, mientras que los factores externos cambiantes no afectan el momento dipolar permanente.
Las fuerzas intermoleculares son las interacciones entre las moléculas. Estas interacciones pueden incluir tanto atracciones como repulsiones. Las atractivas fuerzas intermoleculares causan la formación de compuestos como los cristales. Las fuerzas intermoleculares atractivas más comunes incluyen la unión de hidrógeno, la unión iónica, las interacciones dipolares inducidas por iones, las interacciones dipolares de iones y las fuerzas de van der Waal.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué se induce dipolo?
3. ¿Qué es el dipolo permanente?
4. Comparación lado a lado: dipolo inducido frente a dipolo permanente en forma tabular
5. Resumen
¿Qué se induce dipolo??
El dipolo inducido se refiere al momento dipolo creado en un compuesto no polar debido al efecto de un ion cercano. Aquí, el ion y el compuesto no polar forman una interacción llamada interacción dipolar inducida por iones. La carga del ion induce la creación de un dipolo (una especie química con polarización). Además, el ion puede repeler la nube de electrones del compuesto no polar al acercarse al compuesto no polar.
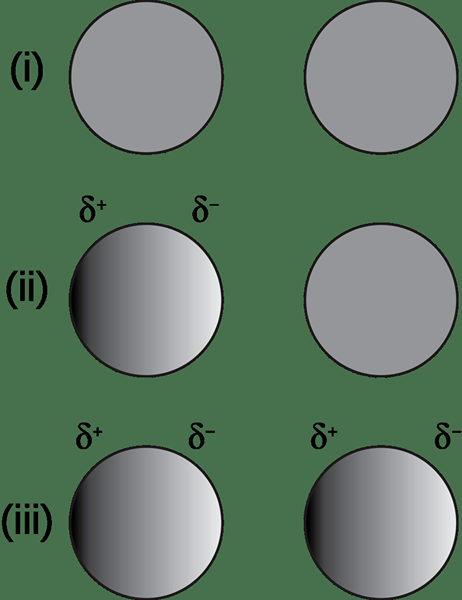
Figura 01: Formación de un dipolo inducido en presencia de una especie cargada
Los iones cargados negativos y positivos pueden causar este tipo de momentos dipolares. Por ejemplo, tomemos un ion cargado negativamente induciendo un momento dipolo en un compuesto no polar. El lado del compuesto no polar que está más cerca del ion obtiene una carga positiva parcial porque la nube de electrones es repelida por los electrones negativos del ion. Esto, a su vez, le da al otro lado del compuesto no polar una carga negativa parcial. Por lo tanto, se crea un dipolo inducido en el compuesto no polar.
Del mismo modo, un ion de carga positivo atrae la nube de electrones, dando una carga negativa parcial al lado del compuesto no polar que está más cerca del ion positivo.
¿Qué es el dipolo permanente??
El dipolo permanente se refiere al momento dipolo que ocurre originalmente en un compuesto debido a la distribución de electrones desigual. Por lo tanto, un compuesto polar contiene un momento dipolar permanente.

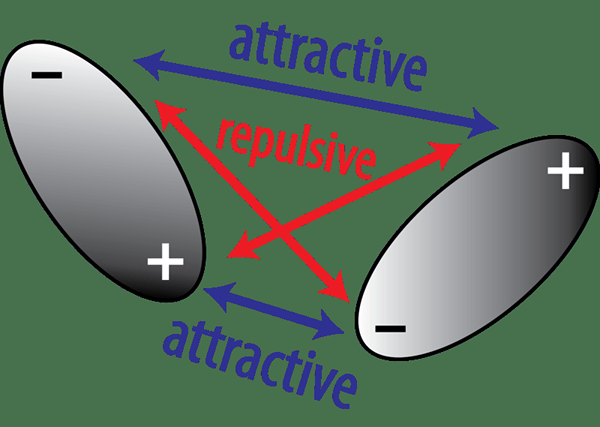
Figura 02: Atracción y repulsión entre dipolos permanentes
Aquí, un compuesto polar contiene dos átomos diferentes con diferentes valores de electronegatividad. Debido a esta razón, los átomos más electronegativos en el compuesto polar atraen electrones de unión que los átomos (s) menos electronegativos. Esto crea un estado en el que un átomo más electronegativo obtiene una carga negativa parcial, mientras que el átomo menos electronegativo obtiene una carga positiva parcial. Esto establece un dipolo permanente en la molécula.
¿Cuál es la diferencia entre el dipolo inducido y el dipolo permanente??
El dipolo inducido se refiere al momento dipolo que se crea en un compuesto no polar debido al efecto de un ion cercano. En contraste, el dipolo permanente se refiere al momento dipolo que ocurre originalmente en un compuesto debido a la distribución de electrones desigual. Además, el diploe inducido ocurre en compuestos no polares, mientras que el dipolo permanente ocurre en los compuestos polares. Por lo tanto, la diferencia clave entre el dipolo inducido y el dipolo permanente es que el momento dipolar inducido puede cambiar cuando los factores que afectan el momento dipolo se cambian, mientras que los factores externos cambiantes no afectan el momento dipolar permanente.
La siguiente infografía tabula la diferencia entre el dipolo inducido y el dipolo permanente.
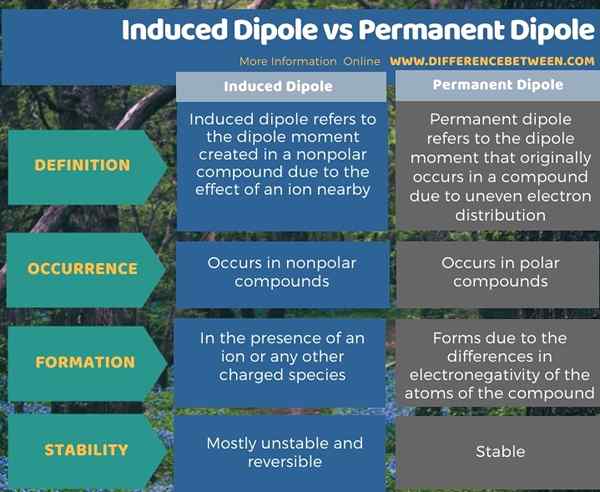
Resumen -dipolo inducido versus dipolo permanente
El dipolo inducido se refiere al momento dipolo que se crea en un compuesto no polar debido al efecto de un ion cercano. En contraste, el dipolo permanente se refiere al momento dipolo que ocurre originalmente en un compuesto debido a la distribución de electrones desigual. Por lo tanto, la diferencia clave entre el dipolo inducido y el dipolo permanente es que el momento dipolar inducido puede cambiar cuando se cambian los factores que afectan el momento dipolo, mientras que los factores externos cambiantes no afectan el momento dipolar permanente.
Referencia:
1."Interacciones dipolares inducidas por iones."Bibliotecas de química, Librettexts, 5 de junio de 2019, disponible aquí.
2. "Fuerza intermolecular."Wikipedia, Fundación Wikimedia, 29 de enero. 2020, disponible aquí.
Imagen de cortesía:
1. "Esquema de una interacción instantánea-dipolo-inducido-dipolo" por Christopher Rowley-Trabajo propio (CC By-SA 4.0) a través de Commons Wikimedia
2. "Esquema de la interacción electrostática entre dos moléculas dipolares" por Cnrowley - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia


