Diferencia entre el efecto inductivo y el efecto electromérico
Diferencia clave: inductivo Efecto vs efecto electromérico
El efecto inductivo y el efecto electromérico son factores electrónicos que influyen en las reacciones químicas de los compuestos orgánicos. El efecto inductivo es el efecto de la transmisión de una carga a través de una cadena de átomos que resulta en un dipolo permanente en un enlace químico. El efecto electromérico es la transferencia completa de electrones Pi en una molécula en presencia de un agente atacante. El diferencia clave entre el efecto inductivo y el efecto electromérico es que El efecto inductivo se puede observar en los enlaces sigma, mientras que el efecto electromérico se puede observar en los enlaces PI.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el efecto inductivo?
3. ¿Qué es el efecto electromérico?
4. Similitudes entre el efecto inductivo y el efecto electromérico
5. Comparación de lado a lado: efecto inductivo frente al efecto electromérico en forma tabular
6. Resumen
¿Qué es el efecto inductivo?
El efecto inductivo es el efecto que la carga de un enlace químico tiene sobre la orientación de los enlaces adyacentes en una molécula. En otras palabras, el efecto inductivo es el efecto de la transmisión de la carga a través de una cadena de átomos en una molécula. Por lo tanto, el efecto inductivo es un fenómeno dependiente de la distancia. El efecto inductivo en una molécula crea un dipolo permanente en enlaces químicos. El efecto inductivo de las moléculas provoca una polaridad inducida.
Cuando dos átomos con diferentes valores de electronegatividad forman un enlace químico (un enlace sigma), la densidad de electrones entre estos átomos no es uniforme. Esto sucede ya que el átomo atrae más electrones con una mayor electronegatividad. Entonces este átomo obtiene una carga negativa parcial en comparación con el átomo menos electronegativo. El átomo electronegativo bajo obtiene una carga positiva parcial.
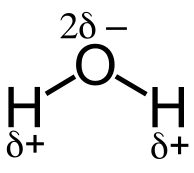
Figura 01: efecto inductivo en una molécula de agua
Si se une un átomo electronegativo a una cadena de átomos, los otros átomos de la cadena obtienen una carga positiva mientras este átomo obtiene una carga negativa. Es un efecto inductivo de retirada de electrones denotado como "-i efecto."En contraste, algunos átomos o grupos de átomos están menos retirados de electrones. Por lo tanto, el efecto inductivo resultado por estas especies químicas se conoce como un efecto inductivo liberador de electrones denotado por "+I efecto."
¿Qué es el efecto electromérico??
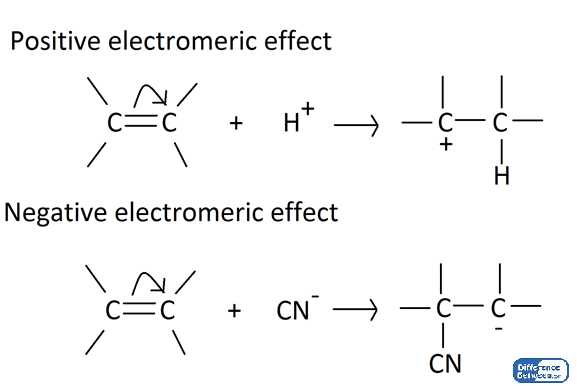
El efecto electromérico es la transferencia completa de electrones Pi en una molécula en presencia de un agente atacante. Por lo tanto, es un efecto de polarización. La transferencia de electrones es intramolecular (ocurre dentro de la molécula). El efecto electromérico se puede observar en las moléculas que contienen múltiples enlaces.
El efecto electromérico ocurre cuando una molécula que tiene múltiples enlaces está expuesta a un agente atacante como un protón (h+). Este efecto es un efecto temporal, pero permanece hasta que se elimina el agente de ataque. El efecto hace que un par de electrones PI se transfiera completamente de un átomo a otro átomo. Crea una polarización temporal, y el agente atacante también está unido a la molécula. Hay dos formas de efectos electroméricos;
- Efecto electromérico positivo (efecto+e)
- Efecto electromérico negativo (-e efecto)

Figura 02: efecto electromérico positivo (efecto+e) y efecto electromérico negativo (-e efecto)
El efecto electromérico positivo Resultados cuando el par de electrones PI se transfiere al átomo al que se adjunta el agente de ataque. En contraste, el efecto electromérico negativo es el resultado de la transferencia del par de electrones Pi a los átomos a los que no está unido el agente atacante.
¿Cuáles son las similitudes entre el efecto inductivo y el efecto electromérico??
- Tanto el efecto inductivo como el efecto electromérico son los efectos electroquímicos que se pueden observar en compuestos orgánicos.
- Tanto el efecto inductivo como los efectos electroméricos causan la polarización de una molécula.
¿Cuál es la diferencia entre el efecto inductivo y el efecto electromérico??
Efecto inductivo versus efecto electrométrico | |
| El efecto inductivo es el efecto que la carga de un enlace químico tiene sobre la orientación de los enlaces adyacentes en una molécula. | El efecto electromérico es la transferencia completa de electrones Pi en una molécula en presencia de un agente atacante. |
| Enlaces químicos | |
| El efecto inductivo se puede observar en los enlaces sigma. | Se puede observar un efecto electromérico en los enlaces PI. |
| Polarización | |
| Efecto inductivo causa formación de un dipolo permanente en enlaces químicos. | Efecto electromérico causa la formación de polarización temporal en moléculas. |
| Formularios | |
| El efecto inductivo se puede encontrar como efecto -i y +i efecto. | El efecto electromérico se puede encontrar como efecto -e y efecto +E. |
| Agente atacante | |
| El efecto inductivo ocurre sin la presencia de un agente atacante. | El efecto electromérico ocurre en presencia de un agente atacante. |
Resumen -inductivo Efecto vs efecto electromérico
El efecto inductivo y el efecto electromérico son los factores electroquímicos de los compuestos orgánicos. El efecto inductivo da como resultado un dipolo permanente en enlaces químicos. Pero el efecto electromérico da como resultado una polarización temporal de moléculas. La diferencia entre el efecto inductivo y el efecto electromérico es que se puede observar el efecto inductivo en los enlaces sigma, mientras que el efecto electromérico se puede observar en los enlaces PI.
Referencia:
1.Helmenstine, D. Ana María. "Aquí está lo que significa el efecto inductivo en la química."THEWLECO. Disponible aquí
2."Efecto electromérico."Wikipedia, Fundación Wikimedia, 18 de diciembre. 2017. Disponible aquí
3.Efectos inductivos y electroméricos. Disponible aquí
Imagen de cortesía:
1.'Agua V.1'by Jü - Trabajo propio, (dominio público) a través de Commons Wikimedia


