Diferencia entre yodometría y yodimetría

El diferencia clave Entre la yodometría y la yodimetría es que Podemos usar yodometría para cuantificar los agentes oxidantes, mientras que podemos usar yodimetría para cuantificar los agentes reductores.
La yodometría y la yodimetría son dos métodos de titulación comunes útiles en química analítica. La base de estos dos tipos de titulaciones es la reducción de oxidación, y podemos usarla para determinar las especies redox cuantitativamente. La base de la titulación es una reacción entre el analito y un reactivo estándar conocido como el titulante. Podemos determinar la cantidad del analito si conocemos la reacción, la estequiometría y el volumen/masa del titulador necesario para reaccionar completamente con el analito. Además, podemos usar yodo para estas titulaciones redox debido a su capacidad de reaccionar rápidamente con muchas especies. Reversibilidad de yodo/yoduro, la reacción también es una ventaja al usarlas en reacciones yodométricas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la yodometría?
3. ¿Qué es la yodimetría?
4. Comparación de lado a lado: yodometría vs yodimetría en forma tabular
5. Resumen
¿Qué es la yodometría??
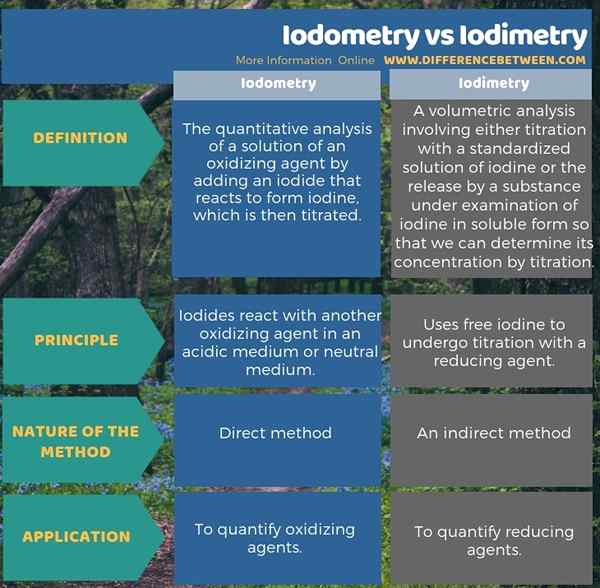
En yodometría, los yoduros reaccionan con otro agente oxidante en un medio ácido o medio neutro. Cuando esta reacción tiene lugar, el yoduro (agregamos yoduro en forma de ki) oxida al yodo y la otra especie sufrirá una reducción por yoduro. Entonces podemos valorar el yodo liberado con otra especie. Esta especie de titulación es una solución estándar de un agente reductor, que es capaz de reducir el yodo a la forma de yoduro. Por lo general, utilizamos una solución de tiosulfato estándar para esto. Por ejemplo, si queremos cuantificar la cantidad de cloro disuelto en una mezcla, el siguiente es el método para llevar a cabo una titulación yodométrica.
Primero, debemos tomar una cantidad conocida de volumen de la mezcla (en la que se disuelve el cloro) en un matraz de valoración. Entonces podemos valorarlo con una solución conocida de ki, y podemos encontrar el volumen consumido.
Después de la reacción redox tendrá lugar en el matraz de reacción;
CL2 + 2i- -> 2 cl- + I2

Figura 01: El cambio de color en la yodometría
Entonces deberíamos llevar a cabo otra titulación con la misma mezcla para determinar la cantidad liberada de yodo. Para esto, podemos valorar la mezcla con una solución de tiosulfato estándar. Necesitamos agregar almidón como indicador, para determinar el punto final de esta reacción. Con yodo y almidón en la mezcla, aparecerá en color azul oscuro, pero en el punto final cuando todo el yodo esté terminado, el color oscuro desaparecerá.
I2 + 2 s2O32− → S4O62− + 2 I-
De las dos titulaciones anteriores, podemos determinar la cantidad de CL2.
¿Qué es la yodimetría??
En yodimetría, usa yodo gratuito para someterse a una titulación con un agente reductor. Por lo tanto, el yodo se reduce al yoduro, y el yodo oxidará otras especies.

Figura 02: Realizar una titulación
Como no podemos preparar fácilmente una solución de yodo gratuita, tenemos que mezclar yodo con yoduro de potasio y ki3 solución para preparar la solución requerida. Y una solución estándar de esto se usa para las titulaciones yodométricas.
Ki+yo2 → Ki3
La siguiente reacción tiene lugar al titular. También podemos usar el almidón como indicador de titulaciones yodométricas.
I2 + Reducir agente → 2 I-
¿Cuál es la diferencia entre yodometría y yodimetría??
La yodometría es el análisis cuantitativo de una solución de un agente oxidante al agregar un yoduro que reacciona para formar yodo, que luego se titula, mientras que la yodimetría es un análisis volumétrico que implica titulación con una solución estandarizada de yodo, o la liberación por una sustancia bajo examen bajo examen de yodo en forma soluble, para que podamos determinar su concentración por titulación. Esta es una diferencia entre yodometría y yodimetría.
Además, otra diferencia entre la yodometría y la yodimetría es que, en yodometría, los yoduros reaccionan con otro agente oxidante en un medio ácido o medio neutro, mientras que en yodimetría, usa yodo libre para sufrir titulación con un agente reductor.
La siguiente infografía presenta la diferencia entre yodometría y yodimetría en forma tabular.
Resumen -Yodometría vs yodimetría
Aunque los dos términos yodometría e yodimetría suenan similares, son dos técnicas diferentes que utilizamos en química analítica. La diferencia clave entre yodometría y yodimetría es que podemos usar yodometría para cuantificar los agentes oxidantes, mientras que podemos usar yodimetría para cuantificar los agentes reductores.
Referencia:
1. "Yodometría."Wikipedia, Fundación Wikimedia, 9 de septiembre. 2018. Disponible aquí
2. Naviglio, Daniele. "Iodometría y yodimetría, Daniele Naviglio" Química analítica "Agraria" Federica E-Learning."Federica, Federica Web Learning, Università di napoli Federico II, 20 mar. 2012. Disponible aquí
Imagen de cortesía:
1."Mezcla de titulación yodométrica" por Lhchem - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia
2."Demostración de titulación a nivel escolar" de UCL - Flickr, (CC por 2.0) a través de Commons Wikimedia


