Diferencia entre las fuerzas dipolo de iones y dipolo dipolo

Diferencia clave: ión dipolo vs Dipolo Fuerzas dipolares
Las fuerzas intermoleculares son las fuerzas de atracción entre diferentes moléculas. Las fuerzas iones-dipolo y las fuerzas dipolo-dipolo son dos formas de fuerzas intermoleculares. Algunos otros ejemplos para las fuerzas intermoleculares incluyen fuerzas dipolares inducidas por iones, enlaces de hidrógeno y fuerzas de van der Waal. Estas fuerzas son atracciones electrostáticas porque las moléculas se sienten atraídas en función de sus cargas eléctricas. El diferencia clave Entre las fuerzas de dipolo iónico y dipolo-dipolo es que Existen fuerzas iónicas entre especies iónicas y moléculas polares, mientras que existen fuerzas dipolo-dipolo entre las moléculas polares.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las fuerzas dipolares de iones?
3. ¿Qué son las fuerzas dipolo dipolo?
4. Similitudes entre iones dipolo y fuerzas dipolo dipolo
5. Comparación de lado a lado - Fuerzas dipolo dipolo vs dipolo en forma tabular
6. Resumen
¿Qué son las fuerzas dipolares de iones??
Las fuerzas iones-dipolo son fuerzas de atracción entre las especies iónicas y las moléculas polares.La especie iónica puede ser un anión (una especie cargada negativamente) o un catión (una especie cargada positivamente).Una molécula polar es cualquier molécula que tenga una separación de carga eléctrica permanente dentro de la molécula debido a las diferencias entre los valores de electronegatividad de los átomos en esa molécula. La electronegatividad es la capacidad de atraer electrones. Cuando un átomo que tiene una alta electronegatividad se une a un átomo que tiene una electronegatividad baja, los electrones de unión son atraídos por el átomo que tiene la alta electronegatividad (luego obtiene una carga negativa parcial), dando al átomo menos electronegativo una carga positiva parcial positiva. Este estado de separación de carga se llama polarización y la molécula se llama molécula polar.
Las fuerzas de dipolo iónico son más fuertes que las fuerzas dipolo-dipolo. Esto se debe a que este tipo de fuerza intermolecular involucra especies iónicas que tienen una carga eléctrica más alta en comparación con una molécula polar. Las fuerzas de dipolo iónico son aún más fuertes que el enlace de hidrógeno. Esta interacción ocurre debido a las interacciones electrostáticas entre el ion y el dipolo.
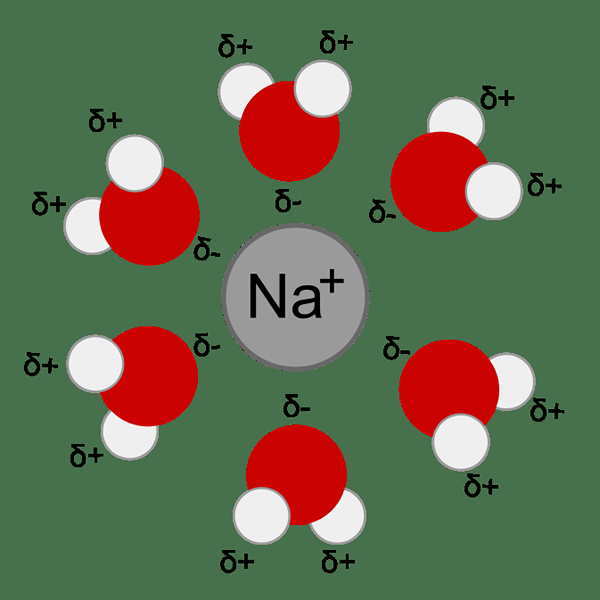
Figura 01: La hidratación de los iones metálicos ocurre debido a la atracción entre el ion metálico y las moléculas de agua (dipolo)
Una subcategoría de las fuerzas de iones-dipolo es las fuerzas dipolares inducidas por iones que involucran una molécula no polar en lugar de una molécula polar. Una molécula no polar no tiene dipolo (sin separación de carga). La carga de ion hace que la molécula no polar se polarice distorsionando la nube de electrones de la molécula no polar.
¿Qué son las fuerzas dipolo dipolo??
Las fuerzas dipolo-dipolo son fuerzas intermoleculares que ocurren entre las moléculas polares. Estas son fuerzas electrostáticas. Al formar este tipo de fuerza, las moléculas polares tienden a estar alineadas para que la atracción entre las moléculas se maximice reduciendo la energía potencial. Esta alineación también reduce las repulsiones entre las moléculas.

Figura 02: Fuerza de atracción entre las moléculas polares de HCL
Cuando se considera una serie de compuestos con masas molares similares (que tienen fuerzas de interacción dipolo-dipolo entre las moléculas), la resistencia de las fuerzas dipolo-dipolo aumenta a medida que aumenta la polaridad. Eso sucede porque cuando la polaridad es alta, significa que la separación de carga es alta. Cuando la molécula tiene una alta separación de carga (terminales positivas y negativas de alta carga en la misma molécula), tiende a atraer cargas opuestas. Esto también conduce a aumentar el punto de ebullición de los compuestos. Mayores las fuerzas dipolo-dipolo, mayor el punto de ebullición.
¿Cuáles son las similitudes entre el ión dipolo y las fuerzas dipolo dipolo??
- Tanto las fuerzas dipolo iones como dipolo dipolo son tipos de interacciones intermoleculares
- Tanto las fuerzas de iones dipolo como dipolo dipolo son fuerzas electrostáticas
¿Cuál es la diferencia entre las fuerzas dipolo de iones y dipolo dipolo??
Fuerzas dipolo de iones vs dipolo dipolo | |
| Las fuerzas dipolares de iones son fuerzas atractivas entre las especies iónicas y las moléculas polares. | Las fuerzas dipolo-dipolo son fuerzas intermoleculares que ocurren entre las moléculas polares. |
| Fortaleza | |
| Las fuerzas de dipolo iónico son más fuertes que los enlaces de hidrógeno y las fuerzas dipolo-dipolo. | Las fuerzas dipolo-dipolo son más débiles que los enlaces de hidrógeno y las fuerzas de iones-dipolo. |
| Componentes | |
| Las fuerzas de iones-dipolo surgen entre iones (cationes o aniones) y moléculas polares. | Las fuerzas dipolo-dipolo surgen entre las moléculas polares. |
Resumen - Dipolo iónico VS Dipolo Fuerzas dipolares
Las fuerzas iones-dipolo y las fuerzas dipolo-dipolo son fuerzas intermoleculares que existen entre diferentes especies químicas, como cationes, aniones y moléculas polares. Las moléculas polares son compuestos covalentes que tienen dipolos (separaciones de carga eléctrica). Una molécula polar tiene un terminal cargado positivamente y un terminal cargado negativamente en la misma molécula. Por lo tanto, estos terminales pueden tener atracciones electrostáticas con cargas opuestas. La diferencia entre las fuerzas iónicas-dipolo y dipolo-dipolo es que existen fuerzas iones-dipolo entre las especies iónicas y las moléculas polares, mientras que existen fuerzas dipolo-dipolo entre las moléculas polares.
Referencia:
1."11.3: Fuerzas dipolo-dipolo."Bibliotecas de química, Librettexts, 11 de febrero. 2018. Disponible aquí
2.Fuerzas dipolo-dipolo. Disponible aquí
3."Fuerza intermolecular."Wikipedia, Fundación Wikimedia, 14 mar. 2018. Disponible aquí
Imagen de cortesía:
1.'Na+H2O'By Taxman (dominio público) a través de Commons Wikimedia
2.'Dipolo-Dipole-Interacción en HCL-2D' por Benjah-BMM27-Trabajo propio, (dominio público) a través de Commons Wikimedia


