Diferencia entre enlaces iónicos y covalentes
El diferencia clave entre los enlaces iónicos y covalentes es que Los enlaces iónicos ocurren entre los átomos que tienen electronegatividades muy diferentes, mientras que los enlaces covalentes ocurren entre átomos con diferencias de electronegatividad similares o muy bajas.
Según lo propuesto por el químico estadounidense g.norte.Lewis propuso que los átomos son estables cuando contienen ocho electrones en su carcasa de valencia. La mayoría de los átomos tienen menos de ocho electrones en sus conchas de valencia (excepto los gases nobles en el grupo 18 de la tabla periódica); Por lo tanto, no son estables. Estos átomos tienden a reaccionar entre sí para volverse estables. Por lo tanto, cada átomo puede lograr una configuración electrónica de gas noble. Los enlaces iónicos y covalentes son los dos tipos principales de enlaces químicos, que conectan los átomos en un compuesto químico.

CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los enlaces iónicos?
3. Who son enlaces covalentes
4. Comparación de lado a lado - enlaces iónicos vs covalentes en forma tabular
5. Resumen
¿Qué son los enlaces iónicos??
Los átomos pueden ganar o perder electrones y formar partículas cargadas negativas o positivas; que llamamos iones. Hay interacciones electrostáticas entre los iones. El vínculo iónico es la fuerza atractiva entre estos iones cargados opuestos. Las electronegatividades de los átomos en un enlace iónico influyen en gran medida en la resistencia de las interacciones electrostáticas entre iones.

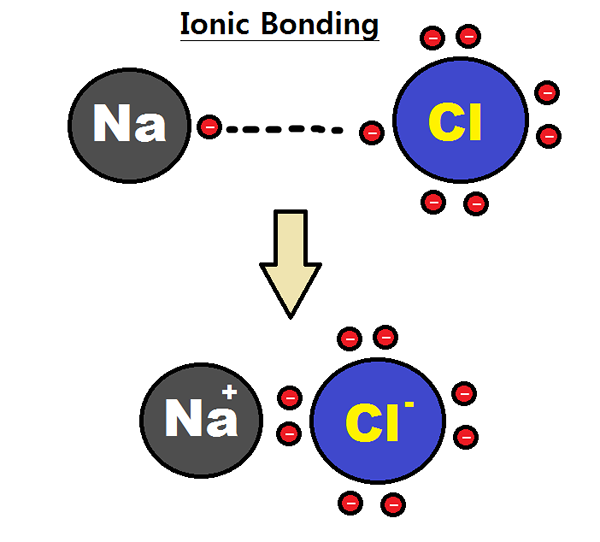
Figura 01: Formación de un enlace iónico entre los átomos de sodio y cloro
La electronegatividad es una medición de la afinidad de los átomos por los electrones. Un átomo, con alta electronegatividad, puede atraer electrones de un átomo con baja electronegatividad para formar un enlace iónico. Por ejemplo, el cloruro de sodio tiene un enlace iónico entre el ion de sodio y el ion de cloruro. El sodio es un metal y el cloro no es metálico; Por lo tanto, tiene una electronegatividad muy baja (0.9) en comparación con el cloro (3.0). Debido a esta diferencia de electronegatividad, el cloro puede atraer un electrón de sodio y formar CL-. Al mismo tiempo, el sodio forma na+ iones. Debido a esto, ambos átomos obtienen la configuración electrónica de gas noble estable. CL- y na+ se mantienen unidos por atractivas fuerzas electrostáticas, formando así un enlace iónico; Enlace NA-Cl.
¿Qué son los enlaces covalentes??
Cuando dos átomos, con una diferencia de electronegatividad similar o muy baja, reaccionan juntos, forman un enlace covalente compartiendo electrones. De esta manera, ambos átomos pueden obtener la configuración electrónica de gas noble compartiendo electrones. La molécula es el producto que resulta de la formación de enlaces covalentes entre átomos. Por ejemplo, los átomos del mismo elemento se unen para formar moléculas como CL2, H2, o P4, Cada átomo se une con otro a través de un enlace covalente.
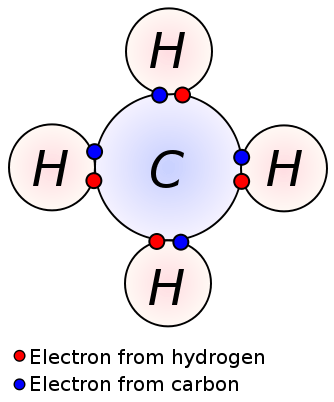
Figura 02: enlaces covalentes entre los átomos de carbono e hidrógeno en la molécula de metano
Molécula de metano (CH4) también tiene enlaces covalentes entre los átomos de carbono e hidrógeno; Hay cuatro enlaces covalentes entre un átomo de carbono central y cuatro átomos de hidrógeno (cuatro enlaces C-H). El metano es un ejemplo de una molécula que tiene enlaces covalentes entre átomos con una diferencia de electronegatividad muy baja.
¿Cuál es la diferencia entre enlaces iónicos y covalentes??
Enlaces iónicos vs covalentes | |
| Un vínculo químico entre dos átomos causados por la fuerza electrostática entre los iones cargados de oposición en un compuesto iónico. | Un vínculo químico entre dos átomos o iones donde se comparten los pares de electrones entre ellos. |
| Número de átomos | |
| Ocurrir entre metales y no metales. | Más comúnmente ocurre entre dos no metales. |
| Número de electrones | |
| Se produce una transferencia completa de electrones. | Ocurre cuando dos (o más) elementos comparten electrones. |
| Compuestos | |
| Generalmente vistos como cristales, en los que pocos iones cargados positivamente rodean un ion cargado negativamente. | Los átomos unidos por enlaces covalentes existen como moléculas, que a temperatura ambiente, existen principalmente como gases o líquidos. |
| Polaridad | |
| Los enlaces iónicos tienen una alta polaridad. | Los enlaces covalentes tienen una baja polaridad. |
| Propiedades físicas | |
| Los compuestos iónicos tienen puntos de fusión muy altos y puntos de ebullición, en comparación con las moléculas covalentes. | Las moléculas covalentes tienen bajos puntos de fusión y puntos de ebullición en comparación con los compuestos iónicos. |
| Solubilidad del agua | |
| En los solventes polares (como el agua), los compuestos iónicos disuelven iones libres; Dichas soluciones son capaces de realizar electricidad. | En los solventes polares, las moléculas covalentes no se disuelven considerablemente; Por lo tanto, estas soluciones son incapaces de realizar electricidad. |
Resumen -enlaces iónicos vs covalentes
Los enlaces iónicos y covalentes son los dos tipos principales de enlaces químicos que existen en los compuestos. La diferencia entre el enlace iónico y covalente es que los enlaces iónicos ocurren entre los átomos que tienen electronegatividades muy diferentes, mientras que los enlaces covalentes ocurren entre átomos con diferencias de electronegatividad similares o muy bajas.
Referencia:
1. Helmenstine, Anne Marie, PH.D. “Definición de enlaces iónicos."Thinkco, febrero. 10, 2017. Disponible aquí
2. Helmenstine, Anne Marie, PH.D. "Definición de enlace covalente."Thinkco, febrero. 7, 2018. Disponible aquí
Imagen de cortesía:
1.'Ionicbondingrh11'by Rhannosh - Trabajo propio, (CC By -Sa 3.0) a través de Commons Wikimedia
2.'Covalent'by Dynablast - Creado con Inkscape, (CC BY -SA 2.5) Vía Commons Wikimedia


