Diferencia entre los compuestos iónicos y covalentes
Diferencia clave: compuestos iónicos vs covalentes
Se pueden observar muchas diferencias entre los compuestos iónicos y covalentes en función de sus propiedades macroscópicas, como la solubilidad en el agua, la conductividad eléctrica, los puntos de fusión y los puntos de ebullición. La razón principal de estas diferencias es la diferencia en su patrón de unión. Por lo tanto, su patrón de unión puede considerarse como el diferencia clave entre compuestos iónicos y covalentes. (Diferencia entre enlaces iónicos y covalentes) Cuando se forman enlaces iónicos, los electrones son donados por un metal y los electrones donados son aceptados por un no metal. Forman un enlace fuerte debido a la atracción electrostática. Los enlaces covalentes se forman entre dos no metales. En la unión covalente, dos o más átomos comparten electrones para satisfacer la regla del octeto. En general, los enlaces iónicos son más fuertes que los enlaces covalentes. Esto lleva a las diferencias en sus propiedades físicas.
¿Qué son los compuestos iónicos??
Los enlaces iónicos se forman cuando dos átomos tienen una gran diferencia en sus valores de electronegatividad. En el proceso de formación de enlaces, el átomo menos electronegativo pierde electrones y un átomo más electronegativo gana esos electrones (s). Por lo tanto, las especies resultantes son iones cargados de manera opuesta y forman un enlace debido a la fuerte atracción electrostática.
Los enlaces iónicos se forman entre metales y no metales. En general, los metales no tienen muchos electrones de valencia en la cubierta más externa; Sin embargo, los no metales tienen más cerca de ocho electrones en la carcasa de valencia. Por lo tanto, los no metales tienden a aceptar electrones para satisfacer la regla del octeto.
Ejemplo de compuesto iónico es na+ + CL- à NaCl
El sodio (metal) tiene solo un electrón de valencia y cloro (no metal) tiene siete electrones de valencia. 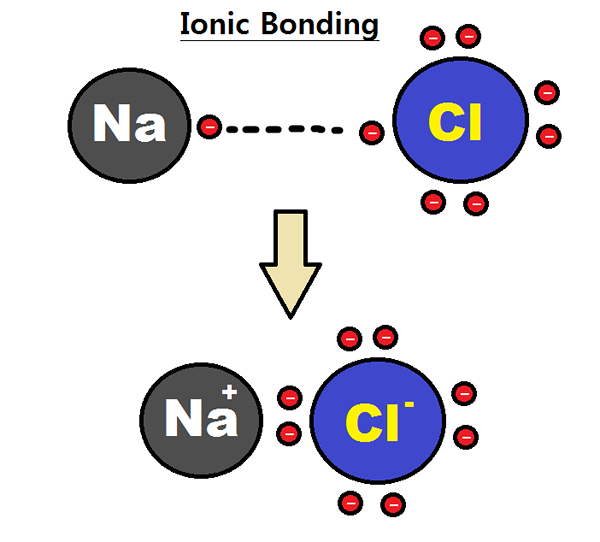
¿Qué son los compuestos covalentes??
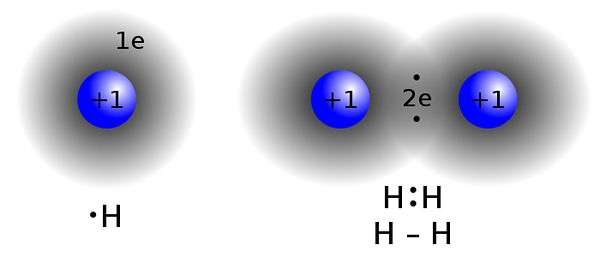
Los compuestos covalentes se forman compartiendo electrones entre dos o más átomos para satisfacer la "regla de octeto". Este tipo de unión se encuentra comúnmente en compuestos no metálicos, átomos del mismo compuesto o elementos cercanos en la tabla periódica.Dos átomos que tienen casi los mismos valores de electronegatividad no intercambian electrones (donar / recibir) desde su carcasa de valencia. En cambio, comparten electrones para lograr la configuración de los octetos.
Ejemplos de compuestos covalentes son metano (CH4), Monóxido de carbono (CO), monobromuro de yodo (IBR)

Unión covalente
¿Cuál es la diferencia entre los compuestos iónicos y covalentes??
Definición de compuestos iónicos y compuestos covalentes
Compuesto iónico: El compuesto iónico es un compuesto químico de cationes y aniones que se mantienen unidos por enlaces iónicos en una estructura de celosía.
Compuesto covalente: El compuesto covalente es un enlace químico formado por el intercambio de uno o más electrones, especialmente pares de electrones, entre átomos.
Propiedades de los compuestos iónicos y covalentes
Propiedades físicas
Compuestos iónicos:
Todos los compuestos iónicos existen como sólidos a temperatura ambiente.
Los compuestos iónicos tienen una estructura cristalina estable. Por lo tanto, tienen puntos de fusión más altos y puntos de ebullición. Las fuerzas de atracción entre iones positivos y negativos son muy fuertes.
| Compuesto iónico | Apariencia | Punto de fusion |
| NaCl - cloruro de sodio | Sólido cristalino blanco | 801 ° C |
| KCL - cloruro de potasio | Cristal vítreo blanco o incoloro | 770 ° C |
| MGCL2- Cloruro de magnesio | Sólido cristalino blanco o incoloro | 1412 ° C |
Compuestos covalentes:
Los compuestos covalentes existen en las tres formas; como sólidos, líquidos y gases a temperatura ambiente.
Sus puntos de fusión y ebullición son relativamente bajos en comparación con los compuestos iónicos.
| Compuesto covalente | Apariencia | Punto de fusion |
| Cloruro de hidrógeno HCL | Un gas incoloro | -114.2 ° C |
| Pez4 -Metano | Un gas incoloro | -182 ° C |
| CCL4 - Tetracloruro de carbono | Un líquido incoloro | -23 ° C |
Conductividad
Compuestos iónicos: Los compuestos iónicos sólidos no tienen electrones libres; Por lo tanto, no realizan electricidad en forma sólida. Pero, cuando los compuestos iónicos se disuelven en agua, hacen una solución que realiza electricidad. En otras palabras, las soluciones acuosas de los compuestos iónicos son buenos conductores eléctricos.
Compuestos covalentes: Ni los compuestos covalentes puros ni las formas disueltas en el agua no conducen electricidad. Por lo tanto, los compuestos covalentes son malos conductores eléctricos en todas las fases.
Solubilidad
Compuestos iónicos: La mayoría de los compuestos iónicos son solubles en agua, pero son insolubles en solventes no polares.
Compuestos covalentes: La mayoría de los compuestos covalentes son solubles en solventes no polares, pero no en el agua.
Dureza
Compuestos iónicos: Los sólidos iónicos son compuestos más duros y frágiles.
Compuestos covalentes: En general, los compuestos covalentes son más suaves que los sólidos iónicos.
Imagen cortesía: "Hidrógeno de enlace covalente" por Jacek FH - Trabajo propio. (CC BY-SA 3.0) a través de Commons "Ionicbondindrh11" por Rhannosh - Trabajo propio. (CC BY-SA 3.0) Vía Wikimedia Commons

