Diferencia entre las interacciones iónicas y electrostáticas
El diferencia clave entre las interacciones iónicas y electrostáticas es que Las interacciones iónicas describen la fuerza de atracción entre dos especies iónicas opuestas. Mientras tanto, las interacciones electrostáticas describen la fuerza de atracción entre dos especies completamente o parcialmente ionizadas con cargas opuestas.
Las interacciones iónicas y electrostáticas son conceptos químicos muy importantes que son útiles para determinar la acumulación de moléculas. Estos también se nombran como enlaces no covalentes. Se forman enlaces químicos covalentes debido al intercambio de electrones entre átomos. Pero, se forman enlaces no covalentes debido a la atracción de especies cargadas que tiene cargas eléctricas opuestas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las interacciones iónicas?
3. ¿Qué son las interacciones electrostáticas?
4. Comparación de lado a lado: interacciones iónicas frente a electrostáticas en forma tabular
5. Resumen
¿Qué son las interacciones iónicas??
Las interacciones iónicas son enlaces iónicos donde dos especies iónicas cargadas opuestas se atraen electrostáticamente entre sí. Es un tipo de enlace no covalente. Además, implica especies químicas completamente cargadas (no especies parcialmente cargadas). Este es el tipo principal de enlace químico que ocurre en los compuestos iónicos.
Los iones son átomos o grupo de átomos que han ganado o eliminado electrones; Esto los hace especies cargadas eléctricamente. Aniones y cationes son los dos tipos de iones. Aniones formados debido a la ganancia de electrones mientras se forman cationes debido a la eliminación de electrones. Por lo tanto, los aniones se cargan negativamente debido a la presencia de exceso de electrones, mientras que los cationes se cargan positivamente debido a la falta de electrones para neutralizar la carga de protones.
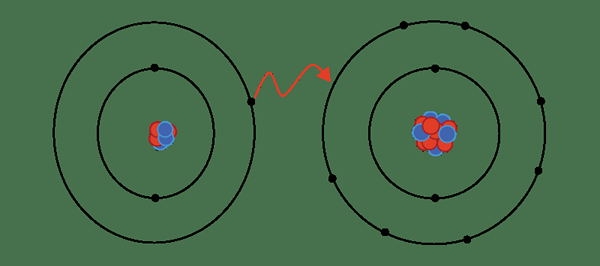
Se forma un enlace iónico cuando el electrón retirado de un átomo (o un grupo de átomos) para formar un catión se obtiene por otro átomo (o grupo de átomos), lo que conduce a la formación de un anión. En el sentido más simple, se forma un enlace iónico cuando se retira un electrón de un metal, y un no metal atrapa este electrón para formar un anión.

Figura 01: Formación de un enlace iónico
Sin embargo, todos los enlaces iónicos tienen cierto grado de características covalentes porque ningún átomo puede eliminar completamente un electrón. Por lo tanto, debemos entender que el término interacción iónica se refiere al momento en que el carácter iónico es mayor en comparación con el carácter covalente.
Casi todos los compuestos iónicos son compuestos sólidos porque las interacciones iónicas son lo suficientemente fuertes como para mantener los aniones y los cationes unidos fuertemente. Sin embargo, los compuestos iónicos fundidos pueden conducir electricidad porque tiene iones que pueden llevar cargos. Además, la alta fuerza de las interacciones iónicas lleva a los compuestos iónicos a tener puntos de fusión muy altos.
¿Qué son las interacciones electrostáticas??
Las interacciones electrostáticas son un tipo de fuerzas de atracción en las que las especies completas o parcialmente iónicas se sienten atraídas entre sí. Además, este término incluye fuerzas atractivas y repulsivas entre las especies iónicas, I.mi. Los iones cargados opuestos se sienten atraídos entre sí, mientras que los mismos cargos se repelen entre sí. Estos también se nombran como enlaces no covalentes porque la fuerza de atracción no incluye ningún electrones entre átomos. Hay tres tipos diferentes de interacciones electrostáticas: interacciones iónicas, enlace de hidrógeno y enlace de halógeno.
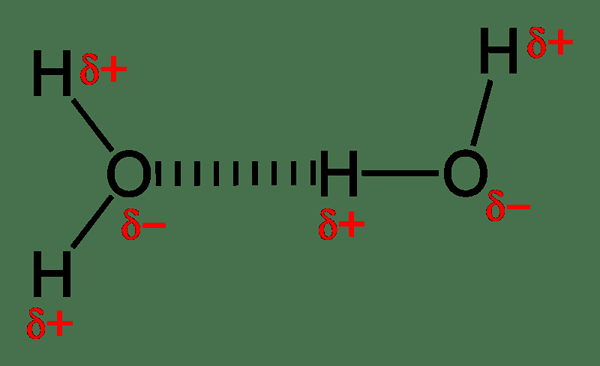
Figura 02: El enlace de hidrógeno es un tipo de interacción electrostática
La interacción iónica incluye la fuerza de atracción entre las especies químicas completamente ionizadas que tienen cargas opuestas, e.gramo. Los aniones atraen cationes. Estas interacciones causan la formación de compuestos iónicos. Estas fuerzas de interacción son muy fuertes; Por lo tanto, los compuestos iónicos existen en el estado sólido. El enlace de hidrógeno es otro tipo de interacción electrostática donde podemos observar una interacción dipolo-dipolo. Esta atracción existe entre un átomo de hidrógeno (que es parcialmente positivo) y un átomo altamente electronegativo (que es parcialmente negativo). Además, la unión de halógeno también es como la unión de hidrógeno, pero la diferencia es la interacción que existe entre un halógeno y un electrofilo.
¿Cuál es la diferencia entre las interacciones iónicas y electrostáticas??
Las interacciones iónicas y las interacciones electrostáticas son enlaces químicos no covalentes. Estos son muy importantes para describir la formación de diferentes moléculas. La diferencia clave entre las interacciones iónicas y electrostáticas es que las interacciones iónicas describen la fuerza de atracción entre dos especies iónicas opuestas, mientras que las interacciones electrostáticas describen la fuerza de atracción entre dos especies completamente o parcialmente ionizadas con cargas opuestas.
A continuación, la infografía resume la diferencia entre las interacciones iónicas y electrostáticas.

Resumen -interacciones iónicas vs electrostáticas
Las interacciones iónicas y las interacciones electrostáticas son enlaces químicos no covalentes. Estos son muy importantes para describir la formación de diferentes moléculas. La diferencia clave entre las interacciones iónicas y electrostáticas es que las interacciones iónicas describen la fuerza de atracción entre dos especies iónicas opuestas, mientras que las interacciones electrostáticas describen la fuerza de atracción entre dos especies completamente o parcialmente ionizadas con cargas opuestas.
Referencia:
1. Helmenstine, Anne Marie. “Definición de enlaces iónicos."Thinkco, Jan. 26, 2019, disponible aquí.
2. Helmenstine, Anne Marie. "Definiciones de química: ¿Qué son las fuerzas electrostáticas??"Thinkco, octubre. 5, 2019, disponible aquí.
Imagen de cortesía:
1. "Vinculación iónica" por Eliseetc / Vectorizada de la unión iónica.PNG - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia
2. "Bonding-en-Water-2D" (dominio público) a través de Commons Wikimedia


