Diferencia entre los compuestos iónicos y moleculares
El diferencia clave entre compuestos iónicos y moleculares es que el Los compuestos iónicos tienen fuerzas de atracción electrostática entre cationes y aniones, mientras que los compuestos moleculares solo tienen enlaces químicos covalentes entre los átomos.
Los elementos químicos pueden unirse entre sí para formar compuestos químicos. Los elementos se unen a través de enlaces químicos que tienen características iónicas o covalentes. Si los compuestos tienen enlaces iónicos, los llamamos como compuestos iónicos, y si tienen enlaces covalentes, entonces son compuestos moleculares. Por lo tanto, la diferencia clave entre los compuestos iónicos y moleculares se encuentra en el enlace químico entre los átomos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Quién son compuestos iónicos?
3. ¿Qué son los compuestos moleculares?
4. Comparación lado a lado: compuestos moleculares iónicos vs en forma tabular
5. Resumen
¿Qué son los compuestos iónicos??
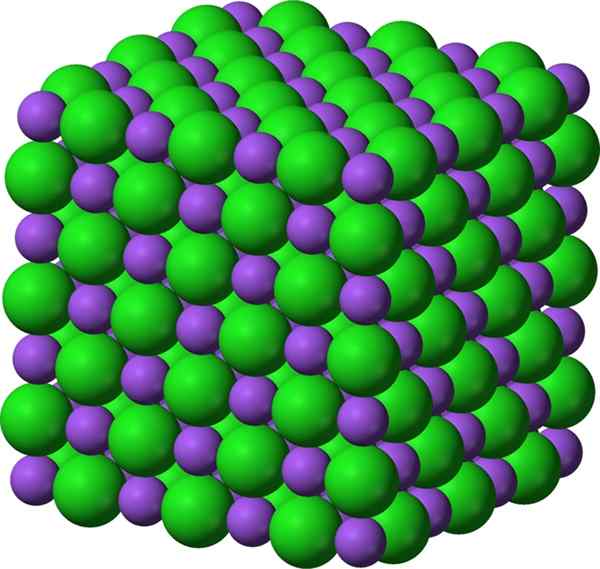
Los compuestos iónicos son los compuestos químicos que tienen cationes y aniones que se unen entre sí a través de la unión iónica. Por lo tanto, hay fuerzas de atracción electrostática entre cationes y aniones. Sin embargo, el compuesto tiene una carga neutral general porque la carga total de los cationes se neutraliza por la carga total de aniones. Estos iones pueden ser monoatómicos o poliatómicos.
Por lo general, los compuestos iónicos que contienen iones de hidrógeno (H+) como el catión son "ácidos". En contraste, iones básicos como el ion hidróxido (OH-) está presente en bases. Si no hay iones de hidrógeno o iones de hidróxido en el compuesto iónico, entonces lo nombramos como una "sal".

Figura 01: Compuesto iónico de cloruro de sodio, que es una sal
Algunos compuestos iónicos como las sales se forman de las reacciones de neutralización ácida-base. Algunos compuestos se forman mediante la evaporación del solvente, reacciones de precipitación, reacciones de estado sólido, congelación, reacciones de transferencia de electrones entre metales y no metales, etc. Por lo general, estos compuestos tienen altos puntos de fusión y ebullición. La mayoría de las veces son duras y frágiles. En su estado sólido, casi todos los compuestos iónicos son aislantes eléctricos, y pueden volverse altamente conductores cuando se disuelven en un solvente como el agua porque los cationes y los aniones pueden moverse libremente.
¿Qué son los compuestos moleculares??
Los compuestos moleculares son compuestos químicos que contienen átomos unidos entre sí a través de enlaces químicos covalentes. Por lo tanto, estos compuestos se forman cuando los átomos comparten sus electrones no apareados entre sí. Los átomos involucrados en este intercambio de electrones tienen valores de electronegatividad similares.
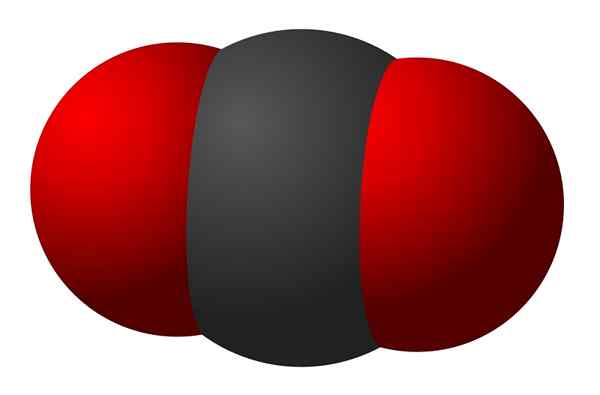
Figura 02: Un diagrama de una molécula triatómica que tiene enlaces covalentes entre los tres átomos
Por lo general, los compuestos moleculares tienen puntos de fusión y ebullición relativamente bajos porque los átomos no están fuertemente unidos entre sí. Del mismo modo, estos compuestos son suaves y relativamente flexibles. En comparación con los compuestos iónicos, estos compuestos moleculares son altamente inflamables. Esto se debe a que casi todas las sustancias inflamables son compuestos moleculares que consisten en átomos de carbono e hidrógeno. A diferencia de los compuestos iónicos, no pueden realizar electricidad cuando se disuelven en un solvente porque no hay iones disponibles para separarse después de disolverse.
¿Cuál es la diferencia entre los compuestos iónicos y moleculares??
Los compuestos iónicos son los compuestos químicos que tienen cationes y aniones que se unen entre sí a través de unión iónica, mientras que los compuestos moleculares son compuestos químicos que contienen átomos unidos entre sí a través de enlaces químicos covalentes. Por lo tanto, la diferencia entre los compuestos iónicos y moleculares se encuentra en la naturaleza de la unión química. Eso es; La diferencia clave entre los compuestos iónicos y moleculares es que los compuestos iónicos tienen fuerzas de atracción electrostática entre cationes y aniones, mientras que los compuestos moleculares solo tienen enlaces químicos covalentes entre los átomos.
Como otra diferencia importante entre los compuestos iónicos y moleculares, los compuestos iónicos son duros y frágiles, mientras que los compuestos moleculares son suaves y relativamente flexibles. Esto se debe principalmente a que los átomos de los compuestos iónicos se mantienen unidos bien mediante enlaces iónicos, mientras que en los compuestos moleculares los átomos se unen entre sí con relativamente libremente. Además, los puntos de fusión y ebullición de los compuestos iónicos son muy altos en comparación con los de los compuestos moleculares.
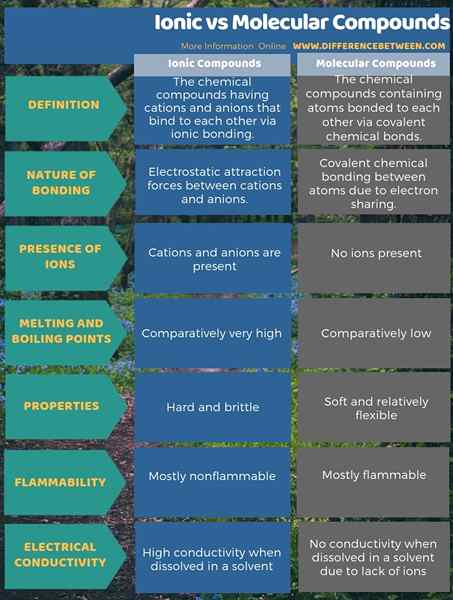
Resumen -compuestos moleculares iónicos vs
Los compuestos iónicos tienen enlaces iónicos, mientras que los compuestos moleculares tienen enlaces covalentes. Por lo tanto, la diferencia clave entre los compuestos iónicos y moleculares es que los compuestos iónicos tienen fuerzas de atracción electrostática entre cationes y aniones, mientras que los compuestos moleculares solo tienen enlaces químicos covalentes entre los átomos.
Referencia:
1. Helmenstine, Anne Marie, PH.D. “Propiedades de compuesto covalente o molecular."Thinkco, junio. 7, 2018. Disponible aquí
2. "Compuesto iónico."Wikipedia, Fundación Wikimedia, 20 de octubre. 2018. Disponible aquí
Imagen de cortesía:
1."" Noruro de sodio-3D-iónico "por Benjah-BMM27-Trabajo propio, (dominio público) a través de Commons Wikimedia
2."Carbon-Dioxide-3D-VDW" de Jacek FH-Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia


