Diferencia entre el producto iónico y el producto de solubilidad
Diferencia clave: producto iónico vs Solubilidad Producto
Tanto el producto iónico como el producto de solubilidad expresan la misma idea del producto de concentraciones de especies iónicas en una solución. El diferencia clave entre el producto iónico y el producto de solubilidad es que iónico El producto es el producto de iones en una solución insaturada o saturada, mientras que el producto de solubilidad es el producto de iones en soluciones saturadas.
El producto de solubilidad es una forma del producto iónico. El producto iónico y el producto de solubilidad difieren entre sí en función del tipo de solución considerada.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el producto iónico?
3. ¿Qué es el producto de solubilidad?
4. Comparación de lado a lado: producto iónico frente al producto de solubilidad en forma tabular
5. Resumen
¿Qué es el producto iónico??
El producto iónico es el producto de concentraciones de especies iónicas en una solución saturada o insaturada. Cuando solo se consideran las soluciones saturadas, el producto iónico se conoce como producto de solubilidad. El término producto iónico es aplicable para todo tipo de soluciones.
¿Qué es el producto de solubilidad??
El producto de solubilidad es la constante de equilibrio para una reacción química en la que un compuesto iónico sólido se disuelve para producir sus iones en solución. El término producto de solubilidad se utiliza solo para soluciones saturadas. El producto de solubilidad se denota por KSP. Consideremos un ejemplo;
Agotamiento+(aq) + CL-(aq)→ AGCL(s)
Si la solución está saturada de AGCL (cloruro de plata), existe un equilibrio entre las especies iónicas solubles y el precipitado AGCL. El producto de solubilidad de esta solución se puede administrar a continuación,
KSP = [AG+(aq)] [CL-(aq)]
Para cualquier solución dada (saturado), el producto de solubilidad es el producto de especies iónicas elevadas en su coeficiente estequiométrico. Para el ejemplo anterior, los coeficientes estequiométricos para AG+ y CL- Los iones son 1. Por lo tanto, las concentraciones de esos iones se elevan a 1.
Cuanto menor sea el producto de solubilidad de una sustancia, luego reduzca la solubilidad de esa sustancia. Esto se debe a que el producto de solubilidad da cuántas especies iónicas disueltas presentes en esa solución. Si la cantidad de especies iónicas es una pequeña cantidad, indica que la sustancia no está bien disuelta en ese solvente. Entonces el producto de solubilidad también es de bajo valor.

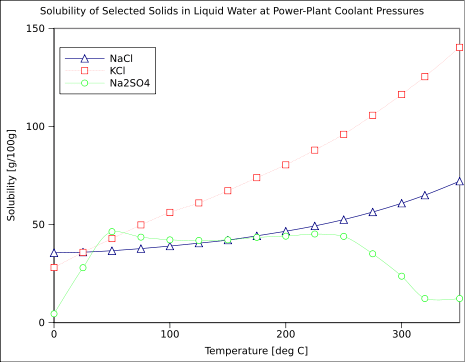
Figura 01: Dependencia de diferentes compuestos en el agua y el efecto de la temperatura de su solubilidad
Un factor importante que afecta el producto de solubilidad de una sustancia es la temperatura. Cuando aumenta la temperatura de una solución, se aumenta la cantidad de solutos disueltos en la que se puede disolver en esa solución; lo que significa que aumenta la solubilidad de un soluto. Esto lleva al aumento del producto de solubilidad. Por lo tanto, las sustancias tienen diferentes productos de solubilidad a diferentes temperaturas.
¿Cuál es la diferencia entre el producto iónico y el producto de solubilidad??
Producto iónico versus producto de solubilidad | |
| El producto iónico es el producto de concentraciones de especies iónicas en una solución saturada o insaturada. | El producto de solubilidad es la constante de equilibrio para una reacción química en la que un compuesto iónico sólido se disuelve para producir sus iones en solución. |
| Tipo de solución | |
| El producto iónico se aplica a soluciones saturadas e insaturadas. | El producto de solubilidad se aplica solo para soluciones saturadas. |
Resumen - Producto iónico vs Solubilidad Producto
El producto iónico y el producto de solubilidad son dos términos que expresan el mismo concepto del producto de las especies iónicas en una solución. La diferencia entre el producto iónico y el producto de solubilidad es que el producto iónico es el producto de iones en una solución insaturada o saturada, mientras que el producto de solubilidad es el producto de iones en soluciones saturadas.
Referencia:
1.Helmenstine, Anne Marie, PH.D. "Definición del producto de solubilidad."Thinkco, nov. 27, 2014. Disponible aquí
2."Diccionario de química."Definición de solubilidad_product_ksp - Diccionario de química. Disponible aquí
Imagen de cortesía:
1.'Solublicidad de dependencia de la temperatura del sólido en el agua líquida a alta temperatura' (CC por 3.0) a través de Commons Wikimedia


