Diferencia entre la ionización y la disociación
Diferencia clave: ionización versus disociación
La ionización y la disociación son dos procesos importantes en química. La ionización y la disociación a menudo se confunden, especialmente en el caso de disolver los compuestos iónicos. Uno podría pensar que la disolución de los compuestos iónicos da como resultado la ionización ya que los compuestos iónicos se disuelven en el agua, produciendo partículas o iones cargados. Pero esta es una instancia de disociación ya que los compuestos iónicos ya están hechos de iones. Por lo tanto, la diferencia clave entre la ionización y la disociación es que La ionización es la producción de nuevos iones por ganancia o pérdida de electrones mientras La disociación es la división o separación de iones que ya existen en un compuesto.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ionización?
3. Que es la disociación
4. Comparación de lado a lado - ionización frente a disociación
5. Resumen
¿Qué es la ionización??
La ionización es el proceso que produce un átomo cargado o una molécula por ganancia o pérdida de un electrón. Este proceso produce una partícula cargada. En este proceso, los átomos neutros eléctricamente se convierten en partículas cargadas eléctricamente. Esta carga puede ser positiva o negativa. Que depende de la ganancia o pérdida de un electrón. Si un átomo o una molécula pierde un electrón, se cargará positivamente, mientras que si gana un electrón desde el exterior, se cargará negativamente. El proceso de ionización suele ser irreversible, lo que significa que, si un átomo o molécula gana un electrón, no libera ese electrones hacia atrás; Si un átomo pierde un electrón, no retrasará un electrón. Eso sucede cuando la pérdida o ganancia de este electrón causa un ion estable, que obedece la regla del octeto.
A veces, el término ionización se confunde con la disociación. Si se considera un compuesto iónico como el cloruro de sodio (NaCl), formará iones cuando se disuelva en agua. Aunque esto forma iones, esto no es ionización. Dado que el NaCl sólido se divide en sus iones o se rompen sus enlaces iónicos, no se puede denominar como ionización. Por lo tanto, la división de un enlace iónico no es un proceso de ionización porque un electrón ya ha dado a un átomo por el otro átomo y solo existe una atracción electrostática. Por lo tanto, se puede decir que los compuestos que tienen enlaces iónicos no participarán en la ionización. Aunque los compuestos iónicos no pueden sufrir ionización, los compuestos covalentes que tienen enlaces covalentes entre los átomos pueden sufrir un proceso de ionización. Esto se debe a que el intercambio de electrones ocurre en enlaces covalentes y la ionización de esos compuestos producirá nuevas partículas cargadas que estaban ausentes en el compuesto anterior. Pero la ionización solo ocurre en compuestos covalentes polares que tienen átomos con una diferencia considerable en la electronegatividad. De lo contrario, la ionización no ocurrirá debido a una fuerte unión covalente. La ionización también tiene lugar en metales. Allí, los iones metálicos cargados positivamente se producen liberando electrones de átomos de metal.
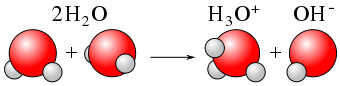
Figura 01: ionización
Que es la disociación?
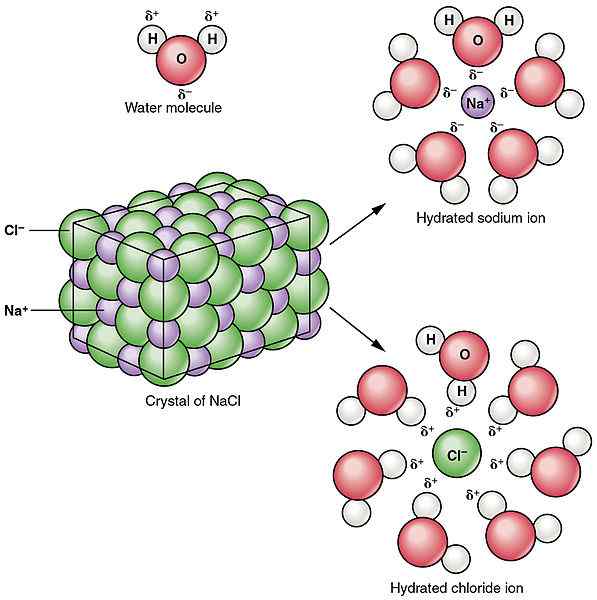
La disociación se refiere a romper o dividir un compuesto en partículas más pequeñas. El proceso de disociación puede dar lugar a productos que están cargados eléctricamente o neutros. Esto no implica la ganancia o pérdida de electrones por los átomos. A diferencia del proceso de ionización, la disociación es la separación de iones que ya existían en un compuesto. A veces, la disociación también puede producir partículas neutrales. Por ejemplo, el desglose de n2O4 resulta en la producción de dos moléculas de NO2. Los procesos de disociación son reversibles la mayoría de las veces. Esto significa que los iones separados se pueden reorganizar para producir el compuesto anterior. Por ejemplo, como se mencionó anteriormente, la disolución de NaCl es un proceso de disociación y produce dos partículas cargadas. Pero, el NaCl sólido se puede obtener nuevamente con las condiciones adecuadas, lo que demuestra que la disociación es reversible. A diferencia de la ionización, la disociación tiene lugar en los compuestos iónicos.

Figura 02: Disociación del cloruro de sodio en el agua
¿Cuál es la diferencia entre ionización y disociación??
Ionización vs disociación | |
| La ionización es el proceso que produce nuevas partículas cargadas. | La disociación es la separación de partículas cargadas que ya existen en un compuesto. |
| Compuesto inicial | |
| La ionización implica compuestos covalentes polares o metales | La disociación involucra compuestos iónicos. |
| Producto | |
| La ionización siempre produce partículas cargadas | La disociación produce partículas cargadas o partículas eléctricamente neutras. |
| Proceso | |
| El proceso de ionización es irreversible. | La disociación es reversible. |
| Cautiverio | |
| La ionización implica enlaces covalentes entre los átomos | La disociación implica enlaces iónicos en compuestos. |
Resumen -ionización frente a disociación
La ionización y la disociación son dos procesos diferentes. Por lo tanto, es muy importante comprender la diferencia entre estos dos procesos. La diferencia clave entre la ionización y la disociación es que la disociación es el proceso de separación de partículas cargadas que ya existían en el compuesto, mientras que la ionización es la formación de nuevas partículas cargadas que estaban ausentes en el compuesto anterior.
Referencias:
1. Hamza, S. A., 2014. Compartir por la diapositiva. [En línea] disponible en: https: // www.slideshare.Net/Sheikhamirhamza/DSSociation-VS-ionizationPPT [Consultado el 29 05 2017].
2. Chang, R., 2010. Química. 10ª ed. Nueva York: McGraw-Hill.
Imagen de cortesía:
1. "214 Disociación de cloruro de sodio en el agua -01" por OpenStax College - Anatomía y fisiología, Sitio web de Connexions. 19 de junio de 2013. (CC por 3.0) a través de Commons Wikimedia
2. "AutoProtolyse Eau" de Cdang - Trabajo propio (dominio público) a través de Commons Wikimedia


