Diferencia entre ionización y electrólisis
El diferencia clave entre la ionización y la electrólisis es que La ionización es la formación de especies químicas que tienen una carga eléctrica, mientras que la electrólisis es el proceso de usar una corriente eléctrica para llevar a cabo una reacción química no espontánea.
La ionización y la electrólisis son procesos muy importantes en química física. Hay diferentes formas de llevar a cabo un proceso de ionización. La electrólisis también se puede utilizar para ionizar especies químicas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ionización?
3. ¿Qué es la electrólisis?
4. Comparación de lado a lado: ionización frente a electrólisis en forma tabular
5. Resumen
¿Qué es la ionización??
La ionización es un proceso químico en el que los átomos o moléculas obtienen una carga positiva o negativa. Ocurre debido a eliminar u obtener electrones de átomos o moléculas, respectivamente. Aquí, los iones resultantes se nombran como cationes o aniones, dependiendo del cargo que tienen, yo.mi. Los cationes son iones cargados positivamente y los aniones son iones cargados negativamente. Básicamente, la pérdida de electrones de un átomo neutro o una molécula forma un catión y la ganancia de electrones de un átomo neutro le da una carga negativa, formando un anión.
Cuando un electrón se elimina de un átomo gaseoso neutro mediante la adición de energía, forma un catión monovalente. Se debe a que un átomo neutro tiene un número igual de electrones y protones, lo que no resulta en una carga neta; Cuando eliminamos un electrón de ese átomo, hay un exceso de protón que carece de un electrón para neutralizar su carga. Por lo tanto, ese átomo obtiene una carga +1 (es la carga del protón). La cantidad de energía requerida para esto es la primera energía de ionización de ese átomo.
Además, la ionización que tiene lugar en una solución líquida es la formación de iones en la solución. Por ejemplo, cuando las moléculas de HCl se disuelven en agua, iones de hidronio (H3O+) están formados. Aquí, HCl reacciona con moléculas de agua y forma iones de hidronio cargados positivamente y cloruro cargado negativamente (CL-) iones.
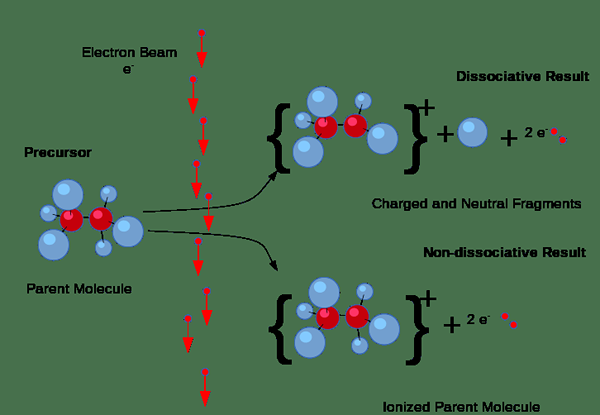
Además, la ionización puede ocurrir a través de colisiones. Pero, este tipo de ionización ocurre principalmente en gases cuando una corriente eléctrica pasa a través del gas. Si los electrones en la corriente tienen una cantidad suficiente de energía requerida para eliminar los electrones de las moléculas de gas, expulsarán los electrones de las moléculas de gas, produciendo pares de iones que consisten en el ión positivo individual y el electrones negativos. Aquí, los iones negativos también se forman porque algunos electrones tienden a unirse a las moléculas de gas en lugar de sacar electrones.
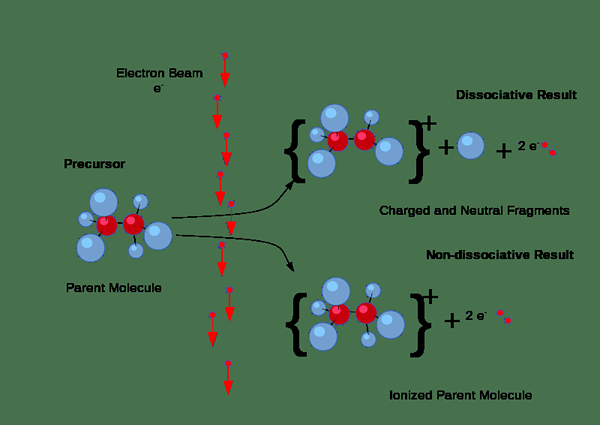
Figura 01: proceso de ionización
Además, la ionización ocurre cuando la energía de radiación o las partículas cargadas suficientemente energéticas pasan a través de sólidos, líquidos o gases; Por ejemplo, las partículas alfa, las partículas beta y la radiación gamma pueden ionizar sustancias; Por lo tanto, los nombramos como radiación ionizante.
¿Qué es la electrólisis??
La electrólisis es el proceso de usar una corriente eléctrica directa para impulsar una reacción química no espontánea. Podemos hacer esto usando una celda electrolítica. La técnica de electrólisis es importante para separar un compuesto en sus iones u otros componentes.
En la electrólisis, una corriente eléctrica pasa a través de una solución para la movilidad de los iones en esa solución. Una célula electrolítica contiene dos electrodos sumergidos en la misma solución. Y esta solución es el electrolito. Un factor esencial en la regulación de la célula electrolítica es "sobre el potencial". Tenemos que proporcionar un voltaje más alto para llevar a cabo una reacción no espontánea. Aquí, también se puede usar un electrodo inerte para proporcionar la superficie para la reacción que ocurre.
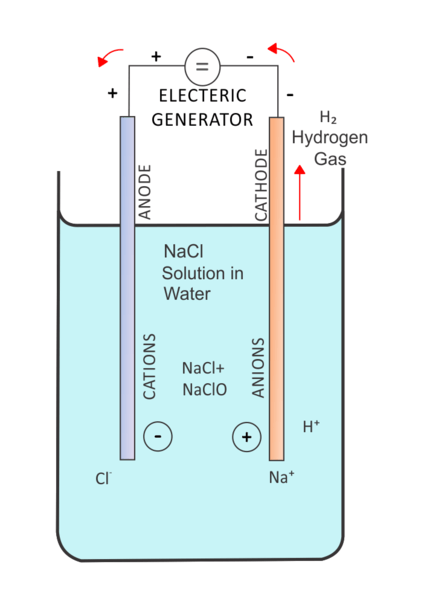
Figura 02: Electrólisis de una solución salina
Hay muchas aplicaciones de electrólisis. Una aplicación común es la electrólisis del agua. Aquí, el agua es el electrolito. Luego, la reacción de la descomposición de las moléculas de agua en gases de hidrógeno y oxígeno se realiza utilizando la corriente eléctrica que se pasa a través del electrolito.
¿Cuál es la diferencia entre ionización y electrólisis??
La ionización y la electrólisis son procesos muy importantes en química física. La diferencia clave entre la ionización y la electrólisis es que la ionización es la formación de especies químicas que tienen una carga eléctrica, mientras que la electrólisis es el proceso de usar una corriente eléctrica para llevar a cabo una reacción química no espontánea.
Al considerar el proceso, la ionización puede tener lugar debido a varias razones, como la reacción entre una especie neutral y un agente ionizante, debido a colisiones, debido a la radiación ionizante, etc. Sin embargo, todos estos métodos conducen a la eliminación o la adición de electrones a los componentes químicos, I.mi. La eliminación de un electrón forma un catión y obtener un electrón forma un anión. La electrólisis también es un método que podemos usar para la ionización de los compuestos. Entonces, esta es otra diferencia entre la ionización y la electrólisis.

Resumen -ionización frente a electrólisis
La ionización y la electrólisis son procesos muy importantes en química física. La diferencia clave entre la ionización y la electrólisis es que la ionización es la formación de especies químicas que tienen una carga eléctrica, mientras que la electrólisis es el proceso de usar una corriente eléctrica para llevar a cabo una reacción química no espontánea.
Referencia:
1. Helmenstine, Anne Marie. “Definición de electrólisis en química."Thinkco, febrero. 7, 2019, disponible aquí.
Imagen de cortesía:
1. "Ionización de electrones" de Evan Mason - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia
2. "Electrólisis de sal" de Sarah.Blumen - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia


