Diferencia entre iones y electrones
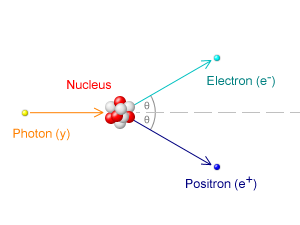
Iones vs electrones
Hay muchas diferencias entre electrones e iones; El tamaño, el cargo y la naturaleza son algunos de ellos. Los electrones son micro partículas cargadas negativamente y los iones son moléculas o átomos cargados de forma negativa o positiva. Las propiedades de los electrones se explican utilizando "mecánica cuántica."Pero las propiedades de los iones pueden explicarse utilizando la química general. Electron (símbolo: β- o ℮-) es una partícula subatómica, y no tiene subpartículas o subestructuras. Pero, los iones pueden tener estructuras aún más complejas con subcomponentes.
¿Qué es un electrón?
Electron fue descubierto por primera vez por J.J. Thompson en 1906 mientras trabajaba con rayos de cátodo que se llaman vigas de electrones. Descubrió que los electrones son micro partículas cargadas negativamente. Solía llamarlos "corpúsculos."Además, descubrió que el electrón es un elemento del átomo y es más de 1000 veces más pequeño que el átomo de hidrógeno. El tamaño del electrón es aproximadamente 1/1836 de un protón.
Según la teoría del bohr, los electrones se orbitan alrededor del núcleo. Pero más tarde, como resultado de experimentos científicos, se descubrió que los electrones se comportan más como ondas electromagnéticas que en órbita de partículas.

Que es un ion?
Como se dijo antes, los iones son moléculas o átomos cargados negativamente o positivamente. Tanto los átomos como las moléculas pueden formar iones aceptando o eliminando electrones. Ellos obtener carga positiva (k+, California2+, Alabama3+) eliminando electrones y ganar carga negativa (cl-, S2-, Alo3-) aceptando electrones. Cuando se forma un ion, el número de electrones no es igual al número de protones. Sin embargo, no cambia el número de protones en el átomo/molécula. La ganancia o pérdida de uno o más electrones tiene un efecto significativo en las propiedades físicas y químicas del átomo/molécula parental.
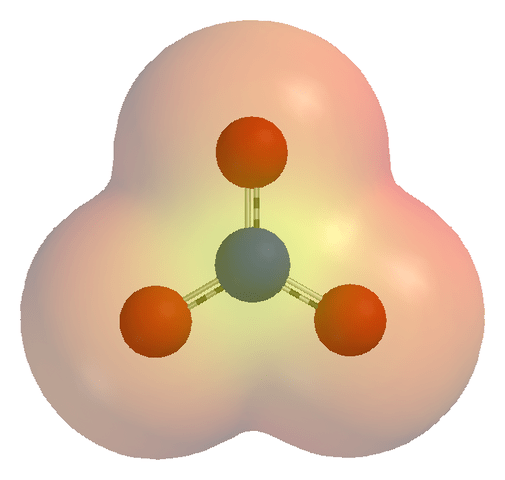
¿Cuál es la diferencia entre electrones e iones??
• Carga eléctrica:
• Los electrones se consideran como partículas elementales cargadas negativamente, pero pueden ser positivas o negativas.
• Los iones con una carga positiva se denominan "iones positivos" y los iones de manera similar con una carga negativa se denominan "iones negativos.Los iones se forman aceptando o donando electrones.
- Ejemplos de iones positivos: na+, California2+, Alabama3+, PB4+, NUEVA HAMPSHIRE4+
- Ejemplos de iones negativos: CL-, S2-, Alo3-
• Tamaño:
• Los electrones son partículas extremadamente más pequeñas en comparación con los iones.
• El tamaño de los iones varía según varios factores.
• El tamaño de un electrón es un valor fijo; es aproximadamente 1/1836 de un protón.
• Estructura atomica:
• Los electrones no son poliatómicos o monatómicos. Los electrones no se combinan entre sí para formar compuestos.
• Los iones pueden ser poliatómicos o monatómicos; Los iones monatómicos contienen solo un átomo, mientras que los iones poliatómicos contienen más de un átomo.
- Iones monatómicos: na+, California2+, Alabama3+, PB4+
- Iones poliatómicos: clo3-, ENTONCES43-
• Partículas:
• Los electrones son micro partículas y poseen propiedades de partículas de onda (dualidad de partículas de onda).
• Los iones se consideran solo como partículas.
• Elementos:
• Los electrones se consideran como partículas elementales. En otras palabras, los electrones no se pueden dividir en componentes o subestructuras más pequeñas.
• Todos los iones tienen subcomponentes. Por ejemplo, los iones poliatómicos contienen varios átomos; Los átomos se pueden subdividir en neutrones, protones, electrones, etc.
• Propiedades:
• Todos los electrones tienen propiedades similares de partículas de onda, que pueden explicarse utilizando la mecánica cuántica.
• Las propiedades químicas y físicas de los iones varían de iones a ion. En otras palabras, diferentes iones tienen diferentes propiedades químicas y físicas.
Imágenes Cortesía:
- Producción de pares por Davidhorman (CC BY-SA 3.0)
- Un mapa de potencial electrostático del ion nitrato (NO3-) a través de wikicommons (dominio público)


