Diferencia entre isoelectrónico e isosteros
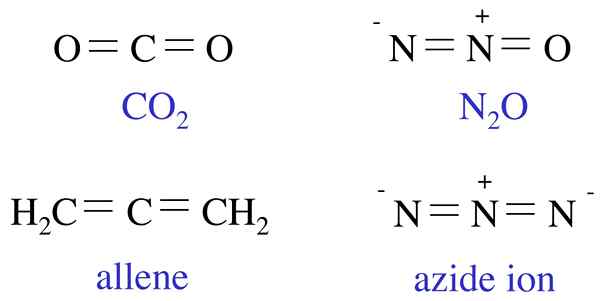
El diferencia clave entre isoelectrónico e isosteros es que el Las especies químicas isoelectrónicas tienen configuraciones electrónicas similares, mientras que los isosteros son especies químicas que tienen un tamaño similar, el mismo número de átomos y electrones de valencia.
El prefijo "iso-" significa que dos o más especies químicas tienen el mismo rasgo característico. Las especies isoelectrónicas y los isosteros son dos de estos tipos de características. Sin embargo, estos dos términos son diferentes entre sí, dependiendo de la característica que se considera entre dos o más especies químicas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es isoelectrónico?
3. ¿Qué son los isosteros?
4. Comparación lado a lado: isoelectrónico vs isosteros en forma tabular
5. Resumen
¿Qué es isoelectrónico??
El término isoelectrónico se refiere a tener el mismo número de electrones o la misma configuración electrónica. Las especies químicas que estamos considerando en este contexto incluyen átomos, iones o moléculas. Estas especies químicas deben tener la misma estructura electrónica del mismo número de electrones de valencia para nombrarlos como especies isoelectrónicas. En otras palabras, este término se refiere a la característica de "igual eléctrica" o "igual carga". Por lo general, estas especies químicas también muestran propiedades químicas similares porque las propiedades químicas de las especies químicas están determinadas por la configuración electrónica de las especies químicas.
Al considerar algunos ejemplos para las especies químicas isoelectrónicas, un ejemplo común sería el átomo y el ion Li+ (catión de litio) donde ambas especies químicas tienen dos electrones en sus átomos/ion. Del mismo modo, K+ (catión de potasio) y Ca+ 2 (catión de calcio) son isoelectrónicos ya que ambos cationes tienen la configuración electrónica [ne] 4S1. Además de los átomos/iones, también podemos dar algunos ejemplos para las moléculas que son isoelectrónicas entre sí, incluida la molécula de monóxido de carbono y la molécula de gas nitrógeno.
Figura 01: Ejemplos de moléculas isoelectrónicas
El concepto de naturaleza isoelectrónica de las especies químicas es útil para predecir las propiedades y reacciones de una especie química. Podemos usar esta característica para identificar átomos similares al hidrógeno que tiene un electrón de valencia y, por lo tanto, son isoelectrónicos a hidrógeno. Además, podemos aplicar este concepto para identificar compuestos desconocidos o raros dependiendo de su semejanza electrónica con una especie química conocida/común.
¿Qué son los isosteros??
El término isostere se refiere a especies químicas que tienen un tamaño similar, el mismo número de átomos y el mismo número de electrones de valencia. Las especies químicas que estamos considerando en este contexto son moléculas o iones. Por ejemplo, el benceno y el tiofeno son moléculas isostéricas. En general, las moléculas isostéricas tienen la misma forma debido a sus disposiciones de electrones idénticas. A menudo, estas especies químicas también tienen propiedades electrónicas similares. El concepto de isosteros fue desarrollado por primera vez por Irving Langmuir en 1919. Más tarde, fue modificado por Grimm.
¿Cuál es la diferencia entre isoelectrónico e isosteros??
La diferencia clave entre isoelectrónico e isosteros es que las especies químicas isoelectrónicas tienen configuraciones electrónicas similares, mientras que los isosteros son especies químicas que tienen un tamaño similar, el mismo número de átomos y electrones de valencia. Además, el isoelectrónico describe átomos, iones o moléculas, mientras que los isosteros describen iones o moléculas. Por ejemplo, el gas monóxido de carbono y el gas nitrógeno son isoelectrónicos entre sí, mientras que el benceno y el tiofeno son isosteros.
La siguiente infografía resume las diferencias entre isoelectrónico e isosteros en forma tabular para la comparación de lado a lado.
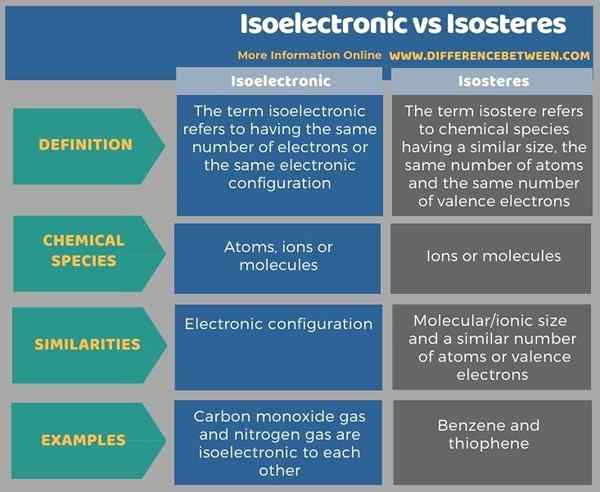
Resumen -isoelectrónico vs isosteros
El término isoelectrónico es diferente del término isosteros porque describen dos características diferentes de las especies químicas. La diferencia clave entre isoelectrónico e isosteros es que las especies químicas isoelectrónicas tienen configuraciones electrónicas similares, mientras que los isosteros son especies químicas que tienen un tamaño similar, el mismo número de átomos y electrones de valencia.
Referencia:
1. Helmenstine, Anne Marie. "Definición isoelectrónica."Thinkco, agosto. 28, 2020, disponible aquí.
Imagen de cortesía:
1. "Moléculas isoelectrónicas" de TEM5PSU - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia


