Diferencia entre isómeros y resonancia

Isómeros vs Resonancia | Estructuras de resonancia vs isómeros | Isómeros constitucionales, estéreo, enantiómeros, diastereómeros
Una molécula o ion que tiene la misma fórmula molecular puede existir de diferentes maneras dependiendo de las órdenes de unión, las diferencias de distribución de carga, la forma en que se organizan en el espacio, etc.
Isómeros
Los isómeros son compuestos diferentes con la misma fórmula molecular. Hay varios tipos de isómeros. Los isómeros se pueden dividir principalmente en dos grupos como isómeros y estéreo constitucionales. Los isómeros constitucionales son isómeros donde la conectividad de los átomos difiere en las moléculas. El butano es el alcano más simple para mostrar el isomerismo constitucional. Butane tiene dos isómeros constitucionales, Butano mismo e Isobuteno.
Pez3Pez2Pez2Pez3 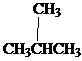
Butano isobutano/ 2-metilpropano
En los estereisómeros, los átomos están conectados en la misma secuencia, a diferencia de los isómeros constitucionales. Los estereoisómeros difieren solo en la disposición de sus átomos en el espacio. Los estereoisómeros pueden ser de dos tipos, enantiómeros y diastereómeros. Los diastereómeros son estereoisómeros cuyas moléculas no son imágenes reflejadas entre sí. Los isómeros trans trans de 1, el 2-dicloroeteno son diastereómeros. Los enantiómeros son estereoisómeros cuyas moléculas son imágenes de espejo no posibles entre sí. Los enantiómeros ocurren solo con moléculas quirales. Una molécula quiral se define como una que no es idéntica con su imagen de espejo. Por lo tanto, la molécula quiral y su imagen de espejo son enantiómeros entre sí. Por ejemplo, la molécula de 2-butanol es quiral, y sus imágenes de espejo son enantiómeros.
Resonancia
Al escribir estructuras de Lewis, solo mostramos electrones de valencia. Al hacer que los átomos compartan o transfieran electrones, tratamos de dar a cada átomo la configuración electrónica de gas noble. Sin embargo, en este intento, podemos imponer una ubicación artificial en los electrones. Como resultado, se pueden escribir más de una estructura de Lewis equivalente para muchas moléculas e iones. Las estructuras escritas al cambiar la posición de los electrones se conocen como estructuras de resonancia. Estas son estructuras que solo existen en teoría. La estructura de resonancia establece dos hechos sobre las estructuras de resonancia.
- Ninguna de las estructuras de resonancia será la representación correcta de la molécula real; Ninguno se parecerá por completo a las propiedades químicas y físicas de la molécula real.
- La molécula real o el ion estarán mejor representados por un híbrido de todas las estructuras de resonancia.
Las estructuras de resonancia se muestran con la flecha ↔. Las siguientes son las estructuras de resonancia del ion de carbonato (CO32-).
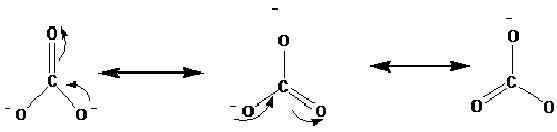
Los estudios de rayos X han demostrado que la molécula real está entre estas resonancias. Según los estudios, todos los enlaces de oxígeno de carbono están en igual longitud en el ion de carbonato. Sin embargo, de acuerdo con las estructuras anteriores, podemos ver que uno es un doble enlace, y dos son enlaces únicos. Por lo tanto, si estas estructuras de resonancia ocurren por separado, idealmente debe haber diferentes longitudes de enlace en el ion. Las mismas longitudes de enlace indican que ninguna de estas estructuras realmente se presenta en la naturaleza, más bien un híbrido de esto, existe.
| Cuál es la diferencia entre Isómeros y resonancia? • En isómeros, la disposición atómica o la disposición espacial de la molécula pueden diferir. Pero en las estructuras de resonancia, estos factores no cambian. Más bien, solo tienen un cambio en la posición de un electrón. • Los isómeros están naturalmente presentes, pero las estructuras de resonancia no existen en la realidad. Son estructuras hipotéticas, que están restringidas solo a la teoría. |


