Diferencia entre isotónico e isosmótico
El diferencia clave entre isotónicos e isosmóticos es que Las soluciones isotónicas contienen solo solutos no penetrantes, mientras que las soluciones isosmóticas contienen solutos penetrantes y no penetrantes. Otra diferencia importante entre las soluciones isotónicas e isosmóticas es que las soluciones isotónicas tienen diferentes presiones osmóticas de las células que rodean, mientras que las soluciones isosmóticas tienen la misma presión osmótica que las células que rodean.
Isotonic e isosmótico son tipos de soluciones y términos que a menudo encontramos en los laboratorios de química. Muchos permanecen confundidos sobre la diferencia entre los dos tipos de soluciones que creen que son los mismos. Sin embargo, no son los mismos y destacaremos sus diferencias en este artículo.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los solutos?
3. Que es isotónico
4. ¿Qué es isosmótico?
5. Comparación de lado a lado: isotónico vs isosmótico en forma tabular
6. Resumen
¿Qué son los solutos??
Los solutos son las sustancias que se disuelven en una solución. Para comprender las soluciones isosmóticas e isotónicas, debemos darnos cuenta de que son solutos penetrantes o solutos no penetrantes. Los solutos penetrantes son aquellos que pueden pasar a través de las membranas de la célula que afectan la presión osmótica a través de la membrana. Por otro lado, los solutos no penetrantes no pueden pasar a través de la membrana, por lo que solo afectan la tonicidad.
Que es isotónico?
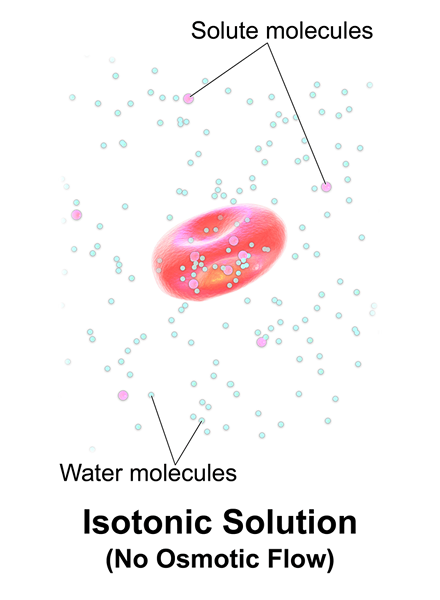
Isotonic es cuando una solución tiene la misma concentración de sal que la sangre y las células del cuerpo humano. Las soluciones isotónicas contienen solo solutos no penetrantes y se refiere a que las soluciones tienen la misma presión osmótica que las células que rodean.

Figura 01: Solución isotónica
Además, no absorben nada de la célula y viceversa (las células tampoco absorben solutos de estas soluciones). Por ejemplo, una solución que es 154 mmnacl es isotónica para los seres humanos.
¿Qué es isosmótico??
Isosmóticos es cuando dos soluciones tienen el mismo número de solutos. Por lo tanto, a pesar del hecho de que tienen la misma presión osmótica que la célula, rodean. Contienen solutos penetrantes que pueden ingresar y aumentar la presión osmótica de la célula. Cuando aumenta la presión osmótica de la célula, lo que hace que la célula absorba el agua del medio, alcanza el equilibrio y la presión osmótica es igual a ambos lados. Esto puede tener un efecto en la celda para que finalmente estalle.
Por ejemplo, la sacarosa es una solución que no tiene iones. Una solución de sacarosa que es 320 mm es isosmótica para los seres humanos. Comparando esta solución de sacarosa con una solución de NaCl de 154 mm, revela que es 154 mmsodium (NA) y 154 mmcloruro (CL) o aproximadamente 308 miliosmolar que está cerca de 320 miliosmolar para sacarosa.
¿Cuál es la diferencia entre isotónico e isosmótico??
Isotonic se refiere a una solución que tiene la misma concentración de soluto que en una célula o un fluido corporal. Isosmóticos se refiere a la situación de dos soluciones que tienen la misma presión osmótica. Por lo tanto, las soluciones isotónicas contienen solo solutos no penetrantes, mientras que las soluciones isosmóticas contienen solutos penetrantes y no penetrantes.
Con consideración a la relación, estos dos tipos de solución tienen con la presión osmótica, las soluciones isotónicas tienen diferentes presiones osmóticas de las células que rodean. Por el contrario, las soluciones isosmóticas tienen la misma presión osmótica que las células que rodean. Además, las soluciones isotónicas no hacen que las células absorban el agua de los alrededores o pierdan agua de las células. Sin embargo, las soluciones isosmóticas hacen que las células absorban el agua de los alrededores o pierdan agua de las células.
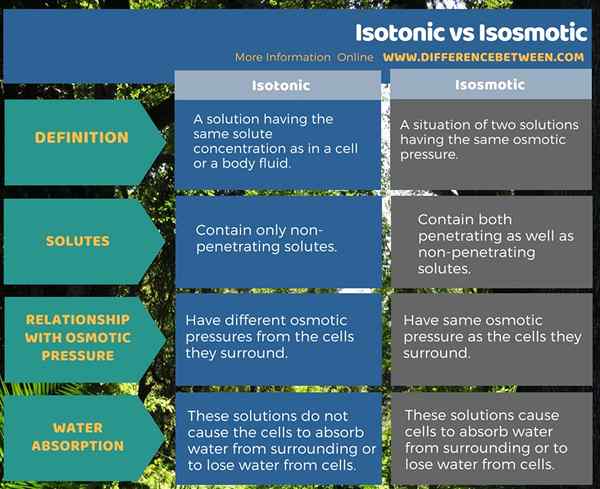
Resumen -isotónico vs isosmótico
Los términos isotónicos e isosmóticos son útiles para describir las propiedades de los fluidos corporales. Ambos términos, Isotonic expresa la idea de tener las mismas concentraciones de soluto, mientras que el término isosmótico expresa la idea de tener presiones osmóticas iguales. La diferencia entre isotónico e isosmótico es que las soluciones isotónicas contienen solo solutos no penetrantes, mientras que las soluciones isosmóticas contienen solutos penetrantes y no penetrantes.
Referencia:
1. "Tonicidad."Wikipedia, Fundación Wikimedia, 8 de febrero. 2018. Disponible aquí
2. "Isosmótico."Biología en línea. Disponible aquí
Imagen de cortesía:
1.'Blausen 0685 Osmoticflow isotonic' por Blausen.COM Staff (2014). "Galería médica de Blausen Medical 2014". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.010. ISSN 2002-4436. - Trabajo propio, (CC por 3.0) a través de Commons Wikimedia


