Diferencia entre isótopos y elementos
El diferencia clave entre isótopos y elementos es que el Los isótopos son diferentes formas del mismo elemento químico, mientras que los elementos son especies de átomos que tienen el mismo número de protones en los núcleos atómicos.
Un tipo similar de átomos puede sufrir ligeros cambios para formar diferentes isótopos. Un elemento puede tener varios isótopos. La naturaleza de cada isótopo contribuye a la naturaleza de un elemento. Aquí, discutiremos en detalle sobre los isótopos y elementos para dilucidar la diferencia entre isótopos y elementos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los isótopos?
3. ¿Qué son los elementos?
4. Comparación de lado a lado: isótopos vs elementos en forma tabular
5. Resumen
¿Qué son los isótopos??
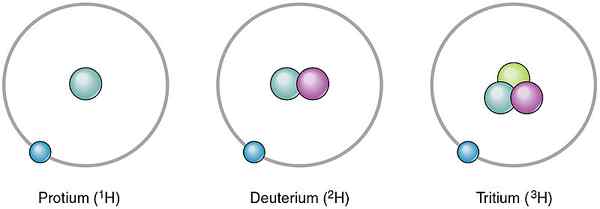
Los átomos del mismo elemento pueden ser diferentes entre sí. Estos diferentes átomos del mismo elemento son los isótopos. Son diferentes entre sí al tener un número diferente de neutrones. Dado que el número de neutrones es diferente, su número de masa también difiere. Sin embargo, los isótopos del mismo elemento tienen el mismo número de protones. En la naturaleza, se producen diferentes isótopos en diversas cantidades. Por lo tanto, podemos dar su ocurrencia como un valor porcentual llamado abundancia relativa. Por ejemplo, el hidrógeno tiene tres isótopos como Protium, Deuterium y Tritium. El número de protones en sus núcleos atómicos es el mismo, pero el número de neutrones es diferente. Sus neutrones y abundancias relativas son las siguientes.
- 1H - Sin neutrones, la abundancia relativa es 99.985%
- 2H- Un neutrón, la abundancia relativa es 0.015%
- 3H- Dos neutrones, la abundancia relativa es 0De %

Figura 01: Isótopos de hidrógeno
El número de neutrones que un núcleo puede contener difiere de un elemento a otro. Entre estos isótopos, solo algunos son estables. Por ejemplo, el oxígeno tiene tres isótopos estables, y el estaño tiene diez isótopos estables. La mayoría de las veces, los elementos simples tienen el mismo número de neutrones que el número de protones. Pero en elementos pesados, hay más neutrones que el número de protones.
Además, el número de neutrones es importante para equilibrar la estabilidad de los núcleos. Cuando los núcleos son demasiado pesados, se vuelven inestables y, por lo tanto, esos isótopos se vuelven radiactivos. Por ejemplo, 238U emite radiación y decae en núcleos mucho más pequeños. Los isótopos pueden tener diferentes propiedades debido a sus diferentes masas. Por ejemplo, pueden tener diferentes giros. Por lo tanto, sus espectros de RMN difieren. Sin embargo, su número de electrones es similar dar lugar a un comportamiento químico similar.
¿Qué son los elementos??
Estamos familiarizados con la palabra "elemento", porque aprendemos sobre ellos en la tabla periódica. Hay alrededor de 118 elementos químicos en la tabla periódica, y están dispuestos de acuerdo con su número atómico. Un elemento es una especie química, que representa solo un tipo de átomos. Por lo tanto, son puros. Además, los átomos del mismo elemento tienen el mismo número de protones en sus núcleos atómicos. Pero, el número de neutrones puede diferir entre sí. Por ejemplo, el elemento más pequeño es el hidrógeno. La plata, el oro, el platino son algunos de los elementos preciosos comúnmente conocidos.
Cada elemento tiene una masa atómica, número atómico, símbolo, configuración electrónica, etc. Aunque la mayoría de los elementos están ocurriendo naturalmente, hay algunos elementos sintéticos como Californium, Americium, Einsteinium y Mendelevium. Podemos clasificar todos los elementos en tres grupos; como metales, metaloides y no metales.
Figura 02: Endoesqueleto
Además, podemos clasificarlos en grupos y períodos basados en características más específicas. Además, los elementos en el mismo grupo o período comparten ciertas características comunes, y algunas propiedades pueden cambiar secuencialmente cuando pasa por un grupo o período. Además, los elementos pueden sufrir cambios químicos para formar varios compuestos; Sin embargo, no podemos descomponer los elementos aún más mediante métodos químicos simples.
¿Cuál es la diferencia entre isótopos y elementos??
El término elemento químico describe una especie de átomos, mientras que el término isótopos describe diferentes formas del mismo elemento químico. Por lo tanto, la diferencia clave entre isótopos y elementos es que los isótopos son diferentes formas del mismo elemento químico, mientras que los elementos son especies de átomos que tienen el mismo número de protones en los núcleos atómicos. Además, otra diferencia entre isótopos y elementos es que los isótopos tienen diferentes números de neutrones, pero los elementos químicos pueden tener el mismo número de neutrones o un número diferente de neutrones; Pero nunca tienen el mismo número de protones.
Como otra diferencia importante entre isótopos y elementos, podemos decir que la masa atómica de un isótopo se puede calcular simplemente agregando la masa total de protones y los neutrones en los núcleos atómicos, mientras que podemos calcular la masa atómica de un elemento químico usando el atómico atómico masas de sus isótopos y su relativa abundancia.

Resumen -Isótopos vs Elementos
Los isótopos son diferentes formas atómicas del mismo elemento químico. La diferencia clave entre isótopos y elementos es que los isótopos son diferentes formas del mismo elemento químico, mientras que los elementos son especies de átomos que tienen el mismo número de protones en los núcleos atómicos.
Referencia:
1. "Elemento químico."Wikipedia, Fundación Wikimedia, 11 de noviembre. 2018. Disponible aquí
2. Helmenstine, Anne Marie, PH.D. "Definición y ejemplos de isótopos en química."Thinkco, octubre. 22, 2018. Disponible aquí
Imagen de cortesía:
1."204 isótopos de hidrógeno -01" por OpenStax College - Anatomía y fisiología, Sitio web de Connexions. (CC por 3.0) a través de Commons Wikimedia
2."Simple Periódico Table Chart -en" de Offnfopt - Trabajo propio, (dominio público) a través de Commons Wikimedia


